放线菌检测方法
一、 检测用培养基配方与培养条件
1. 培养基:高氏1号培养基
配方:可溶性淀粉 2g ,KNO3 0.1g ,K2HPO4 0.05g ,MgSO4• 7H2O 0.05g ,NaCl 0.05g ,FeSO4• 7H2O 0.001g (母液) ,琼脂 2g ,自来水 100mL 。
先把淀粉放在烧杯里,用5毫升水调成糊状后,倒入95毫升水,搅匀后加入其他药品,使它溶解。在烧杯外做好记号,加热到煮沸时加入琼脂,不停搅拌,待琼脂完全溶解后,补足失水。调整pH值到7.2~7.4,分装后灭菌,备用。
2. 培养条件: 温度:27℃-30℃;时间:36--48小时。
二、检测与计数方法
1. 系列稀释
称取适量的样品,加入带玻璃珠的三角瓶中,加入100mL的无菌水(无菌水中事先加入了分散剂1—2滴,分散剂可以是吐温,OP—10,用来分散菌团),用玻璃棒搅拌使之溶解吸水均匀后上旋转式摇床200 r/min充分振荡40—60 min,,即成母液菌悬液(基础液)。
2. 用1mL无菌移液管分别吸取1.0mL上述母液菌悬液加入9 mL无菌水中,按1:10进行系列稀释,分别得到1:1×101,1:1×102,1:1×103,1:1×104……1:1×k稀释的菌悬液(每个稀释度应更换无菌移液管)。
3. 加样及培养
取1个适宜的稀释度,用移液枪吸取菌悬液0.1 mL,加至预先制备好的固体培养基平板上,用无菌玻璃刮刀将菌悬液均匀地涂于琼脂表面。此稀释度重复3次,同时以空白作对照,于适宜的条件下培养。
4. 菌落识别
根据所检测菌种的技术资料,每个稀释度取不同类型的代表菌落通过涂片、染色、镜检等技术手段确认有效菌。当空白对照培养皿出现菌落数时,检测结果无效,应重做。
5. 菌落计数
以出现20—150个菌落数的稀释度的平板为计数标准,分别统计有效活菌数目和杂菌数目。有效菌平均菌落数在20—150之间时,则以该菌落数计算。
有效活菌数按式(1)计算,同时计算杂菌数:
nm = kv1/(m0v2) ×10-8 或 nv = kv1/(v0v2) ×10-8 (1)
式中:
nm — 质量有效活菌数, 亿/g
nv — 体积有效活菌数, 亿/mL
— 有效菌落平均数, 个
k — 稀释倍数
v1 — 基础液体积, mL
v2 — 菌悬液加入量, mL
v0 — 样品量, mL
m0 — 样品量, g
重点需要注意的部分在菌悬液的制备及震荡过程上,因为固态发酵的的产品大部分为聚集状态不容易分散开来,这点与液态发酵产品不同。所以:
① 悬液中要加分散剂分散菌团;
② 震荡时间也要较液态发酵产品时间长,使用旋转式摇床控制在180——200r/min 。
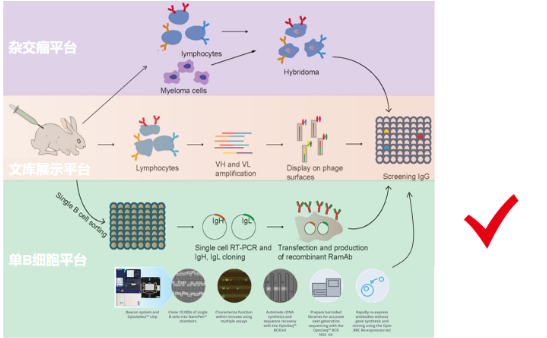
我公司目前与多个实验室开展技术合作,拥有WB、免疫组化、ELISA、多肽合成、液质检测、蛋白纯化和芯片中心等数个实验平台,开展的技术服务涵盖免疫组化、WB、ELISA、抗体定制、多肽合成、病理、分子、蛋白、细胞、动物造模等几十项实验,每一项实验都由经验丰富的专业人员负责完成。公司优势是可以承接整体实验课题,从拟写标书,实验设计、动物造模,包括后期检测分析,到整理数据发表文章我们都可以做,如有需要请随时咨询。
咨询
- 212
- 点赞
- 复制链接
- 举报