骆驼单域抗体:作为挽救生命治疗的前景和挑战
自1993年发现骆驼重链抗体(VHHs/单域抗体/纳米抗体)以来,其作为研究、诊断和治疗工具一直备受关注。1996年至2001年期间,比利时和荷兰的开创性研究小组获得了多项商业专利。Ablynx成立于2001年,旨在探索纳米抗体药物的治疗应用和开发。Ablynx经过二十多年的广泛努力开发出成了首个获得EMA和FDA批准的纳米抗体药物caplacizumab (Cablivi)(2018-2019
【前言】
基于IgG的单克隆抗体(mAbs)在过去几十年已广泛用于医学研究,截至2021年12月有100种IgG mAbs药物被批准。IgG分子由两条相同的重链(包含VH、CH1、CH2和CH3四个结构域)和两条相同的轻链(包含VL和CL两个结构域)组成四聚体结构。抗体可变区(VH和VL)内的短片段表现出高度的可变性,它们直接参与抗原结合,被称为高变区/环或互补决定区(CDR)(图1)。
这些结构域采用保守的Ig折叠结构,由两层反平行的β折叠组成,与疏水氨基酸侧链紧密堆积,形成β桶状或三明治状结构。IgG的C末端区域(也被称为可结晶片段或Fc)包含CH2和CH3结构域,非常保守并具有各种效应功能。抗原结合片段(Fab)包含两个可变区(VH和VL)和两个恒定区(CH1和CL)。Fab与Fc之间还有一个铰链区(各类型IgG之间的长度不同),该区对于使Fab旋转158°以及Fab-Fab、Fab-Fc分别获得115-172°、66-123°的角度方面起着至关重要的作用。
经过对几种哺乳动物物种Ig变体的结构、遗传学和功能结合进行几十年深入分析,抗体的传统概念发生了巨大变化。20世纪90年代,布鲁塞尔自由大学Raymond Hamers教授领导的研究小组从摩洛哥健康单峰骆驼的血清中发现缺乏轻链的较小IgG亚类。1993年发表的第一组数据显示,单峰骆驼的血清除了常规的IgG(IgG1;MW~150 kDa)外,还含有两个较小的免疫球蛋白(IgG2和IgG3;MW~90 kDa),它们缺乏轻链和第一个重链恒定结构域(重链抗体或HCAbs),共占血清IgG总量的75%(图1)。随后对其他骆驼科动物(美洲驼和羊驼)的研究表明,HCAbs存在的浓度较低(25-50%)。最重要的是,在本报告中,通过放射免疫沉淀和印迹试验,从暴露于伊氏锥虫的单峰骆驼上证明了HCAbs的抗原结合活性。
抗体基因克隆研究揭示了HCAbs可变结构域的独特序列。为区别于传统的VH结构域,使用“VHH”来表示骆驼科的可变结构域。随后,使用溶菌酶和破伤风类毒素两种模型抗原免疫的单峰骆驼序列构建了噬菌体展示VHH文库,以检验通过噬菌体筛选分离骆驼VHHs的可行性。经过四轮筛选,分离并鉴定出了对溶菌酶和破伤风类毒素具有纳摩尔亲和力的VHHs。通过尺寸排除色谱法证明了VHH的可溶性,显示VHH是单体,没有聚合的倾向。圆二色光谱(在197-215 nm之间)显示了VHH如预期的Ig β-折叠的结构。
【内容介绍】
1.骆驼科VHHs的结构
解析VHH和VHH-溶菌酶复合物的载脂蛋白晶体结构揭示了抗溶菌酶VHH相当独特的特征,其中CDR3的N端片段渗透到溶菌酶的催化位点,CDR3 C端折叠在VL前界面上,屏蔽了VHH中一些剩余的疏水区域(例如Phe 42)。更多的结构研究表明,除了识别酶活性位点和蛋白质表面的其他空腔外,VHH-抗原还有许多其他的相互作用,包括VHH识别蛋白质上的平面,甚至形成凸互补位以提高与小分子和半抗原结合的能力。
为了全面了解VHH与抗原之间的相互作用,最近一项对105个VHH-抗原晶体结构(分辨率<3 Å)的结构研究显示,VHH倾向于识别更刚性、凹面、保守和结构化的表位,这些表位富含芳香氨基酸、极性氨基酸、带电氨基酸和疏水氨基酸。该研究还发现,CDR3参与了大约50%的相互作用,而CDR2和CDR1分别占所有相互作用的20%和13%。最重要的是,非CDR残基达到了所有相互作用的16%,主要位于VHH支架上的四个不同区域,即第一个β-链(A)、FR2的N端区域、C”D环以及DE环(CDR4)。综上所述,VHH似乎利用了VHH-抗原复合物中每一个可接近的残基来加强结合亲和力。相比之下,另一项对227种传统抗体-抗原复合物结构的研究发现,80%的相互作用局限于4-13个残基。此外,在30个对结合亲和力有重要贡献的突出位置中,有3个位于框架区域,其余27个位于CDR区域,这表明传统抗体比HCAbs更依赖于通过CDR区域的氨基酸结合。总之,这些发现表明VHH-抗原相互作用不同于常规抗体-抗原相互作用,而是更类似于蛋白质-蛋白质相互作用。
VHH A.20(PDB 4NBX;尺寸约为 2.5×4×3 nm)显示为带有重叠网格的画和表面表示。该分子以俯视互补位的视图定向,CDR1/2/3分别被标记为深绿色、红色和蓝色。灵活的非CDR区域以浅色突出显示,包括N末端(绿色)、框架 2(蓝色)、C”D 环(红色)和 DE 环(橙色)。VHH A.20与毒素A 的CDR和非CDR 热点中的接触点被标记为黄色棒,β-链标记为A到G。
2.骆驼科HCAbs的遗传起源
研究表明,来源于共同祖先的HCAbs具有精确的分子进化机制,在骆驼适应性免疫系统中具有独特的功能。研究发现:(a)在HCAbs中拼接第一个恒定结构域(CH1),导致重组的VHH外显子直接附着到不同长度(0-27aa)的铰链区;(b)骆驼基因组的FR2中存在特定的氨基酸替换,主要位于传统抗体中与VL接触的VH侧;(c)HCAbs的CDR环较长,偏离人类和小鼠Igs的标准环结构。例如,与人类、小鼠等传统单抗的VH结构域中的CDR(2-19 aa)相比,VHH CDR3(3-28 aa)显示出更广泛的长度分布。
HCAbs保留了独特的进化机制,使VHH互补位文库多样化。(a)具有相对较大的VHH微基因片段库与两个较小的DH和JH微基因重组,并在V-D-H连接处有较高的插入/缺失率;(b)FR3区(残基76-78)中重组信号序列的高发生率与重组激活基因蛋白的基因置换现象有关;(c)CDRs中的体细胞超频突变率较高,包括CDR1中的一个新的热点超突变密码子(TAY),并进一步延伸至非CDR区域,尤其是FR3;(d)在FR2和CDR区域具有额外的半胱氨酸残基;(e)FR2区残基参与抗原相互作用和形成CDR3环。总而言之,进化机制积极参与了VHH谱系的多样化,与传统VHs相比,增加了VHH-抗原相互作用中非CDR残基的贡献,从而弥补了VL结构域的缺失。
基因组学研究表明,传统抗体可变区和HCAb可变区(VH和VHH)均由IGV基因编码,其中VHs和VHHs具有一组独特但混合的基因。这些微基因与相同的IGD和IGHJ基因重组以生成单个VDJ基因片段,用于VH和VHH的转录。骆驼科动物之间存在相同的VH和VHH基因结构,羊驼大约有17个VHH微基因,单峰骆驼大约有42个VHH微基因。羊驼基因组和cDNA序列的同源性分析表明,在igh基因座上至少存在三个V亚群:IGHV1(与人类IGHV家族II中的VH家族2、4和6同源);IGHV2(相当于具有人类VH家族1、5、7的IGHV家族II);IGHV3(相当于具有人类VH3家族的人IGHV家族III)。所有已鉴定的羊驼VHH基因都与人类IGHV3同源,并根据序列相似性聚类为六个子集。美洲驼的cDNA序列分析表明,根据序列相似性,VHH序列可以进一步分为四个亚家族,每个亚家族显示出前面讨论的VHHs的一个或多个特征,例如较长的CDR3s、额外的二硫键以及存在新的正则结构的三个CDR环。
此外,美洲驼IgG基因谱库中发现了一组具有明显前导信号并与人类VH4家族有高度同源性的V基因。这些VH基因在FR2中不存在VHH增溶取代的印记;然而,VDJ产物可以被重新排列,以编码常规抗体或HCAbs的重链。因此,这些V结构域可能有助于增加传统抗体和HCAbs的多样性。由于与人类VH4有很高的同源性(79-89%),提示这些抗原特异性VHs无需进行人源化步骤。这种潜力在筛选针对树突状细胞上CD11c+的VH4结构域得到证明。
3.骆驼科单域抗体作为治疗药物的研究进展
Ward及其同事在20世纪80年代首次提出将VH结构域作为一个独立的单域抗原结合单位的想法。在《自然》杂志的一篇报道中,研究小组发现了独立VH结构域与其对应Fv (VH:VL)的结合特性,该Fv对应来自于小鼠单抗(D1.3)或来自于免疫溶菌酶的小鼠脾脏的VH文库。VH结构域可与靶抗原特异性结合,虽然亲和力降低了10倍,但可以通过基因工程技术来提高,其溶解性和稳定性也需要进一步的基因工程技术处理。这些缺点导致单域抗体没有引起足够的商业兴趣。HCAbs的发现重新点燃了单域抗体的想法。由于天然缺乏轻链,HCAbs可以克服小鼠和人类VH结构域中观察到的溶解和聚集行为。HCAbs不是曾报道的人工制品或重链病抗体。随后应用抗体工程和噬菌体展示技术克隆了不同的骆驼重链抗体片段,确定了VHH是一个独立的抗原结合域,具有良好的生物物理化学性质。
VHH发展的第一个十年的主要科学进展包括:(a)从cDNA库获得VHH序列,并定义VHH家族;(b)骆驼科动物基因组研究揭示了VHH和VH基因片段的位置,并证明了VHH序列的种系印记;(c)应用噬菌体展示技术从免疫文库中分离出VHHs,其中一些被证明是酶抑制剂;(d)几种VHH-抗原复合物的高分辨晶体结构,揭示了与传统的抗体-抗原相互作用的重要偏差;(e)使用细菌和酵母系统大量表达VHH,并对各种纯化方案进行评估,以获得高纯度的VHH蛋白;(f)使用VHHs作为免疫亲和纯化和免疫灌注的试剂。
VHH发展的第二个十年(2003-2013年),出版物和专利申请呈指数增长。这十年的主要标志是Ablynx(赛诺菲)等人开始对纳米抗体作为治疗和显像剂进行临床前和临床研究,主要包括:(a)用于控制血小板聚集和血凝块形成的血糖蛋白vWF;(b) 用于治疗RSV病毒感染;(c)用于中和毒素;(d)用于治疗类风湿性关节炎的IL6-R;(e)使用放射性标记纳米抗体进行HER2+肿瘤成像。此外,VHHs在异源系统中的表达,以及在制备具有卓越功效的二价和多价VHHs方面也取得了重大技术进步。
自2014年以来,VHHs的研究取得了几项重大进展。Ablynx完成治疗域抗体(Caplacizumab)的临床I期试验,为纳米抗体在医学上的应用奠定了基础。与此同时,Ablynx与默克、勃林格殷格翰、赛诺菲等大型生物制药公司合作推出了20多个临床前和临床项目。在2018年底,第一个纳米抗体药物caplacizumab(治疗罕见凝血障碍的二价抗vWF纳米抗体)获得了EMA批准,并于2019年2月获得FDA批准并进入市场。随着对VHH的知识产权限制逐渐减少,生物制药和生物技术公司对VHH在医学、工业和研究领域的潜在应用的研究兴趣越来越大。例如,日本大正药业使用了由Ablynx生产的抗肿瘤坏死因子(TNF)VHH,并开发了一种人源化的三特异性纳米抗体ozoralizumab(两个抗TNF VHH与一个抗HSA VHH相连)。该治疗药物目前正在接受日本药品和医疗器械管理局 的审查。截至2021年,超过25家公司与Ablynx合作开发VHH用于分子诊断和治疗(表1)。与此同时,在Ablynx、诺华、勃林格殷格翰、艾伯维和默克等大型制药公司的赞助下,目前有16种治疗性VHH正在进行临床试验或即将进入临床试验。
4.骆驼科动物单域抗体的优点、缺点和应用
优点
首先,克隆出的免疫VHH抗体库与体内成熟的重链抗体库基本一致。构建单链抗体库需要借助连接子人工连接VH和VL结构域,其稳定性和正确折叠可能会被影响,同时还会失去原始的VH-VL配对,需要更大的抗体库来捕获所有组合。作为单个结构域,VHH结构域抗体不需要VH和VL结构域的合成组装或链结合,所以其避免了常规抗体片段抗体库构建、筛选和表达有关的复杂问题。VHH抗体库在噬菌体或其他筛选平台上也具有较强的遗传稳定性和高效折叠。此外,他们不需要复杂的折叠,所以在细菌系统中很容易完成表达。
缺点
尽管VHHs有上述许多优点,但VHHs在进一步工程设计或某些应用中,还存在一些限制。VHHs的单结构域性质使得每个残基在抗原-抗体相互作用中的参与更加重要。我们在VHH人源化方面的经验表明,VHH只允许有限数量的修饰,完全人源化会导致其亲和力急剧下降,稳定性及表达产量降低。
VHH结构不是检测或捕获小分子的最优选择。与传统抗体片段的平面或凹面拓扑结构相比,VHH的凸面拓扑结构不能理想地与靶标分子相互作用。
最后,免疫动物难以获得。为了克服这一限制,已经建立了转基因小鼠品系,该品系具有重排的单峰骆驼γ2a链或杂交骆驼/人抗体位点,可产生功能性骆驼或杂交骆驼-人重链抗体。Xu J等人使用携带羊驼、单峰骆驼和双峰驼VHH基因库的转基因小鼠,分离出对SARS-CoV-2变种有效的中和VHHs,这些变种能识别传统抗体无法识别的受体结合域(RBD)结构域上的保守表位。
应用
如今,VHHs已进入几乎所有的生物学研究领域,有无数关于VHH对癌症、生化和血液疾病、神经炎症、传染性病原体和特有疾病生物标记物分离和鉴定的报告。如前所述,VHHs由于其体积小、具有凸出CDR3的特殊表面拓扑结构,能够识别较大抗体片段或单克隆抗体无法识别的表位,同时避开了小分子药物缺乏特异性和脱靶毒性的缺点。
VHHs可用于癌症治疗和肿瘤成像。VHHs的小尺寸使其具有快速外渗、深层肿瘤组织渗透和快速组织/血液清除的独特优势。一种检测乳腺癌的68Ga NOTA放射性标记抗HER2+ VHH目前正在进行II期临床试验。VHHs对恶劣环境(高热、胃肠道、化学变性、非生理pH值和高压)的高度耐受性使其成为口服和气雾剂治疗、抗体药物结合物以及微芯片生物传感器固定化的理想试剂。
VHHs的另一个潜在应用是治疗神经退行性疾病。与用于治疗神经退行性疾病的小分子药物相比,抗体疗法具有强靶向特异性,且基于VHH的疗法具有穿透血脑屏障的能力,这为大脑研究和治疗打开新思路。与没有VHH的对照组相比,以双特异性、脂质体介导或Fc融合的形式从天然美洲驼或免疫库中分离的几种VHH(例如FC5、FC44、抗IGF1R5和抗VCAM VHH)能够将靶肽/药物的传递提高10-30倍。尽管VHH-Fc抗体融合蛋白的小尺寸优势被削弱了,但其在血液循环中半衰期延长,改善蛋白的输送。为了最大限度地向大脑输送抗体,仍然需要进行广泛的研究,以确定理想的抗体改造靶点。FDA最近批准了由Biogen开发的第一种治疗阿尔茨海默病的人IgG1单克隆抗体生物药物aducanumab。这种药物清除阿尔茨海默病患者大脑中的特征蛋白 β-淀粉样蛋白团块。然而,这种治疗需要静脉注射高剂量的抗体(600-750 mg/月),其中只有1.5%的抗体渗透到大脑中。这表明治疗方案仍有改进的空间,例如增加血脑屏障穿透率。
传染病和新兴病原体是VHHs具有独特应用的其他重要研究领域。如前所述,VHH-抗原复合物的结构研究表明,VHHs倾向于针对更刚性、保守和结构化的表位。这对于开发物种交叉反应性VHH治疗药物,对抗不断突变以逃离宿主免疫系统的感染性疾病靶点具有重要意义。大量针对细菌和病毒病原体的VHH已被研究,其中一些进入临床试验阶段。在新型冠状病毒肺炎大流行期间,人们努力寻找能够阻断/中和SARS-CoV-2感染的被动免疫治疗试剂。利用噬菌体或核糖体展示技术,在较短的时间内从天然、合成/半合成和免疫文库,或从携带骆驼VHH基因的转基因小鼠构建的文库中分离出许多具有阻断或中和SARS-CoV-1和SARS-CoV-2能力的VHHs。有研究表明,一些VHH在串联使用时,可以耐受几乎所有SARS-CoV-2谱系中发现的免疫逃逸突变。这些VHHs在皮摩尔(pM)浓度下中和病毒,具有优异的热稳定性(高达95◦C)。有趣的是,该研究组还报告了一些能够协助大肠杆菌中RBD结构域折叠的VHH,这一发现为未来的疫苗生产中使用简单、低成本的细菌系统表达VHH及其他难以表达的抗原奠定了基础。
6.单克隆抗体市场和骆驼单域抗体的前景和挑战
骆驼VHHs作为“第三代”抗体,比传统的抗体在生物技术上具有更大优势,预计将在未来几年将主导生物市场。市场上第一种治疗性单域抗体TPP的治疗成本约为$270,000,虽然这种基于VHH的药物被认为是免疫治疗的重要突破,对患者的疗效有明显改善,但在目前的应用中似乎并不具有成本优势,将VHH作为单抗的廉价替代品的愿望并未实现。基于VHH的治疗和诊断试剂未来仍需在减少成本方向继续发展,以更低的价格进入市场。
7.结语
VHH发现至今,发表了无数研究文章和专利,其相关商业成果正在逐步进入制药市场。与传统单抗类似,VHHs正在被开发用于传染病、癌症、中枢神经系统疾病等各种疾病。尽管早期存在一些挑战和挫折,但随着第一个基于VHH的治疗药物上市和另外16个处于临床不同阶段的VHH药物的批准,VHH似乎正逐渐在生物制剂市场找到自己的一席之地。在接下来的十年里,将有更多基于VHH的治疗和诊断试剂进入市场。
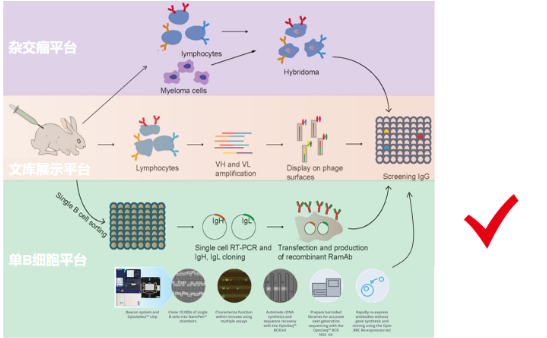
卡梅德生物拥有成熟的四大核心技术服务平台:
1、稳定细胞系筛选与基础分子生物学平台;
2、抗体工程技术平台;
3、蛋白服务平台;
4、噬菌体展示技术服务平台;
我们成功研发了众多用于科学研究以及新药发现的重组蛋白、抗体、抗体药物靶点蛋白、工业酶、诊断原料等相关试剂,竭诚为您提供服务。
咨询
- 177
- 点赞
- 复制链接
- 举报