一起学习吧 | 蛋白质纯化技术“了解了解”?
蛋白质纯化方法使用分级纯化技术,即根据蛋白质的不同特性进行逐步分离和富集。
这些特性包括:
• 溶解度:蛋白质在不同溶剂中的溶解程度,受到蛋白质中氨基酸的极性和疏水性的影响。
• 尺寸:由蛋白质中氨基酸的数量和排列决定。
• 电荷:蛋白质在不同 pH 缓冲液中的净电荷不同,由蛋白质中氨基酸的电荷状态决定。
• 结合特异性:蛋白质与其他分子或配体的亲和力,由蛋白质中氨基酸的结构和功能决定。
为了进行有效和高效的蛋白质纯化,需要使用检测方法来识别和测量目标蛋白质。检测方法有多种不同的形式,很大程度上取决于目标蛋白质的类型(例如是否是酶等)。
常用的检测方法有:
• 光谱法:利用蛋白质对光或染料的吸收或发射特性来测量其浓度或纯度(SDS-PAGE、BCA、蛋白A280紫外吸收等)。
• 免疫学法:利用特异性抗体与目标蛋白质的结合反应来检测其存在或数量(WB、ELISA、IP、IF等)。
本文将就蛋白质多级纯化中所用到的基本技术进行简要概况总结。
蛋白质粗提物是指从含有目标蛋白质的生物材料中提取出的未经进一步分离和纯化的蛋白质混合物。
初提物的制备方法取决于目标蛋白质的来源和位置,例如:
• 如果目标蛋白质是肌肉蛋白质,可以将肌肉组织磨碎或切割,然后用适当的缓冲液和抑制剂悬浮和匀浆,得到肌肉匀浆液。
• 如果目标蛋白质是细胞内蛋白质,可以将细胞培养物或组织样本用机械或化学方法破坏细胞壁和膜,释放出细胞内的内容物,得到细胞裂解液。
• 如果目标蛋白质是血液蛋白质,可以将血液样本用抗凝剂处理,然后用离心或沉淀法分离出血浆或血清。

在进行蛋白质粗提物的制备过程中需要注意以下几点:
• 使用合适的缓冲液和抑制剂,以保持目标蛋白质的稳定性和活性,防止其变性、降解或失活。
• 尽量减少操作时间和温度,以避免不必要的酶反应或氧化还原反应。
• 尽量提高目标蛋白质的收率和纯度,以减少后续分离步骤的难度和成本。
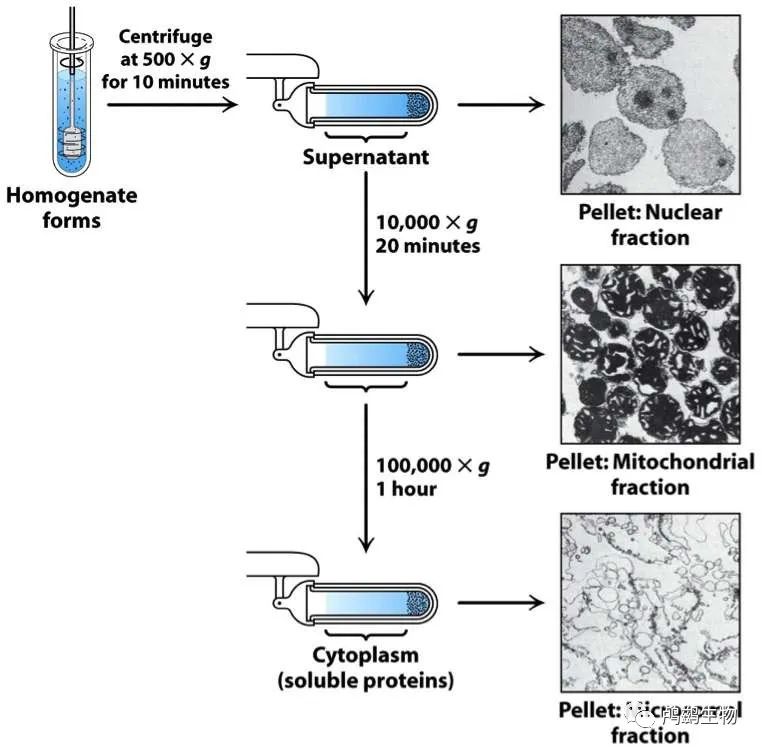
离心是一种利用离心力将混合物中不同密度的成分分离的实验技术。可以用于从粗提物中去除大的物质,如细胞碎片,或者从上清液中分离出不同的细胞组分,如核,线粒体,溶酶体等。
原理是:当混合物在高速旋转的离心机中旋转时,较重的成分会受到较大的离心力,向离心机轴远离的方向移动,形成沉淀或沉积;而较轻的成分会受到较小的离心力,向离心机轴靠近的方向移动,形成上清液或悬浮液。
将含有目标蛋白质的混合物装入适当的离心管或瓶中,放入离心机中,并设定好所需的速度和时间。然后启动离心机,等待离心结束后,取出离心管或瓶,并小心地倒出上清液或悬浮液,留下沉淀或沉积。如果需要进一步分离不同的细胞组分,可以重复进行多次不同速度和时间的离心,这称为差速离心。
离心法的注意事项是:
选择合适的缓冲液和抑制剂,以保持目标蛋白质的稳定性和活性;
选择合适的速度和时间,以达到最佳的分离效果;
使用检测方法来鉴定和定量目标蛋白质,以避免不必要的损失或污染。

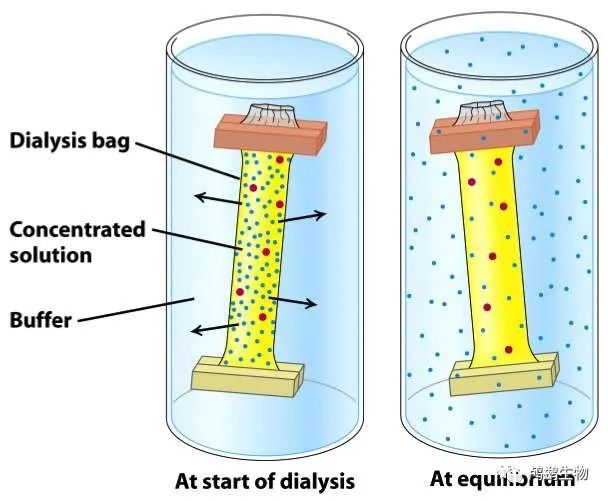
透析法是一种利用半透膜将蛋白质溶液中的溶剂或小分子与外部缓冲液进行交换的实验技术。可以用于改变蛋白质溶液中的 pH,盐度,温度等条件,以保持或改善目标蛋白质的稳定性和活性。
透析法的原理是:当蛋白质溶液放置在半透膜(如透析袋)内,而半透膜悬浮在较大体积的缓冲液中时,由于渗透压的作用,水和小分子(如离子,糖,氨基酸等)可以通过半透膜自由移动,而大分子(如蛋白质)则不能通过半透膜。这样,蛋白质溶液和缓冲液之间的水和小分子会不断地交换,直到达到平衡状态。
透析法的操作方法是:将含有目标蛋白质的溶液装入合适大小和孔径的透析袋中,封闭好口部,然后将透析袋浸入较大体积的缓冲液中,并轻轻搅拌。根据需要,可以定期更换缓冲液,以加快交换速度。透析结束后,取出透析袋,并小心地收集蛋白质溶液。
注意事项是:
选择合适的缓冲液和抑制剂,以保持目标蛋白质的稳定性和活性;
选择合适的半透膜和透析条件,以达到最佳的交换效果;
避免使用过高或过低的温度,以防止蛋白质变性或沉淀;
避免使用过强或过弱的机械搅拌,以防止蛋白质破坏或泄漏。
柱层析法是一种利用不同的树脂(固相)和缓冲液(流动相)将蛋白质混合物中的不同成分分离的实验技术。
根据蛋白质的不同特性进行分离,例如:
• 尺寸:利用树脂中的孔隙大小过滤不同大小的蛋白质,称为凝胶过滤或尺寸排除层析。
• 电荷:利用树脂上的正负电荷吸附或排斥不同电荷的蛋白质,称为离子交换层析。
• 亲和力:利用树脂上的特定配体或抗体与目标蛋白质的结合反应,称为亲和层析。
柱层析法的操作方法是:将含有目标蛋白质的溶液加载到装有适当树脂和缓冲液的玻璃圆筒(柱)中,然后通过改变缓冲液的流速,pH,盐度等条件,使不同成分以不同的速度通过柱,并在柱出口处收集不同的管(级分)。
注意事项是:
选择合适的树脂和缓冲液,以保持目标蛋白质的稳定性和活性;
选择合适的柱和条件,以达到最佳的分离效果;
使用检测方法来鉴定和定量目标蛋白质,以避免不必要的损失或污染。
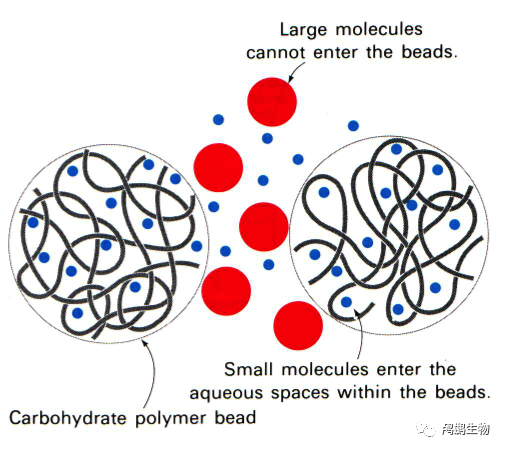
➤4.1、凝胶过滤/尺寸排阻层析
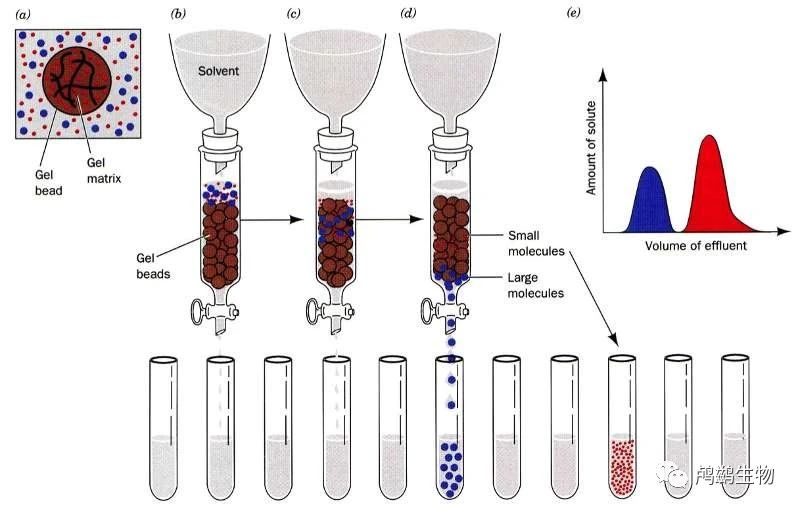
在凝胶过滤中,树脂是多孔的(见图)。某些分子(此处以蓝色表示)可以进入树脂,不会沿直线路径通过;因此,小分子穿过层析柱所需的时间比大分子穿过树脂外部所需的时间更长。
下图突出显示了这一点,其中大分子(蓝色)首先被滤出,而较小分子(红色)随后被滤出。
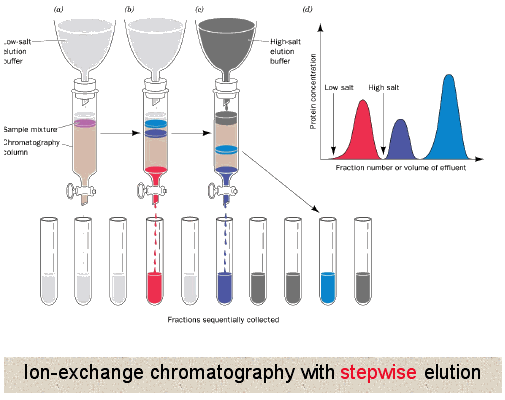
➤4.2、离子交换层析
可分为两种类型,阴离子交换和阳离子交换。这种方法使用具有不同电荷强度的树脂部分,从弱电荷到强电荷,使得分子能够相互作用。与凝胶过滤层析不同,离子交换层析中蛋白质直接与树脂相互作用。因此,通常在柱中使用缓冲溶液进行平衡,以建立恒定的pH值,然后加载蛋白质混合物,根据它们的电荷与树脂相互作用。随后,继续施加缓冲液,直到所有不与树脂相互作用的蛋白质被洗掉。在此阶段,通常会施加盐浓度逐渐增加的梯度(通过破坏离子和氢键),使相互作用最弱的蛋白质首先被释放,然后是相互作用更强的蛋白质,最后是相互作用最强的蛋白质。此外,也可以通过改变施加到柱上的缓冲液的pH值来实现这一目的。
阴离子交换剂意味着它从蛋白质混合物中去除阴离子,因此树脂必须带有正电。在洗脱开始之前,带正电和不带电的蛋白质将落入柱中。开始洗脱时,首先去除带有较弱负电荷(例如-1电荷)的蛋白质,然后是带有较强负电荷(-2电荷)的蛋白质,最后是带有最多负电荷(-3电荷)的蛋白质。
阳离子交换与阴离子交换相反,意味着它从蛋白质溶液中去除阳离子,因此树脂必须带有负电。同样,在洗脱开始之前,带负电和不带电的蛋白质将落入柱中。开始洗脱时,首先去除带有较弱正电荷(例如+1电荷)的蛋白质,然后是带有较强正电荷(+2电荷)的蛋白质,最后是带有最多正电荷(+3电荷)的蛋白质。
➤4.3、亲和层析
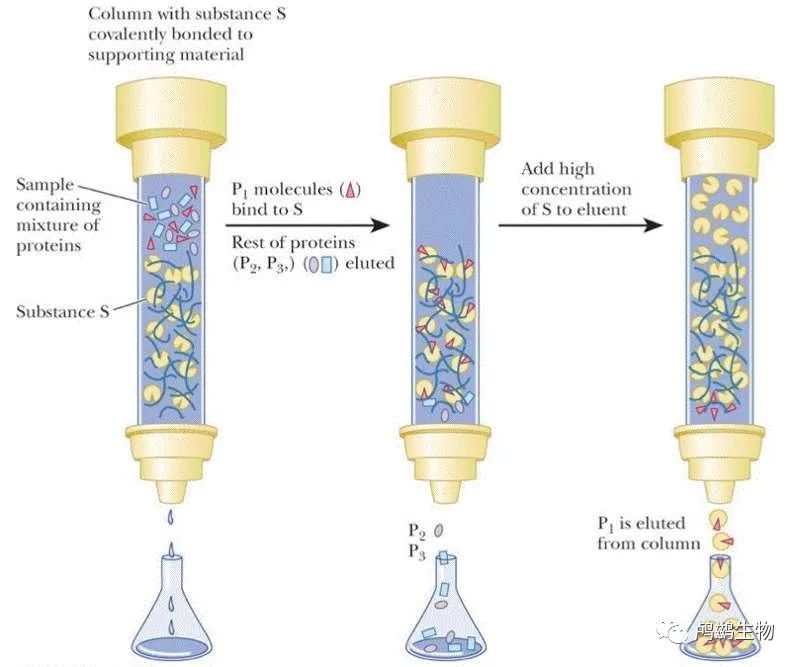
是一种利用特定的配体或抗体(固相)和缓冲液(流动相)将蛋白质混合物中的特异性成分分离的实验技术。
亲和层析需要事先知道目标蛋白质的结合特性或标签,例如:
• 结合特性:指目标蛋白质能够与某些天然或人工的分子或配体发生特异性结合反应,如 NAD+,ATP,生物素,Antibody等。
• 标签:指目标蛋白质在基因工程中被添加的一段短肽序列或融合蛋白,以便于识别和分离,如 His 标签,GST 标签,FLAG 标签等。
亲和层析的原理和操作方法如下:
使用带有特定配体或抗体的树脂,与目标蛋白质的结合特性或标签相匹配,形成亲和复合物,排斥其他不结合的蛋白质。加载蛋白质混合物后,先用缓冲液洗去不结合的蛋白质,然后用适当的洗脱液洗脱结合的蛋白质。
洗脱液的选择取决于结合反应的类型和强度,例如:
pH 变化:利用酸碱性对结合反应的影响,改变缓冲液的 pH 值,使亲和复合物解离。
盐度变化:利用盐浓度对结合反应的影响,增加缓冲液中的盐浓度,使亲和复合物解离。
竞争性抑制:利用与目标蛋白质具有相同或类似结合特性或标签的分子或配体,与树脂上的配体或抗体竞争结合位点,使亲和复合物解离。
金属螯合剂:利用能够与金属离子形成稳定络合物的分子或配体,从树脂上移除金属离子,使亲和复合物解离。

蛋白多级纯化策略应该遵循以下原则:
➤简单化:尽可能地减少纯化步骤和操作复杂度,避免不必要的损失和变性。
➤差异化:尽可能地利用目标蛋白质与其他成分的差异性,选择合适的分离方法和条件,提高分辨率和回收率。
➤平衡化:尽可能地平衡纯化的目标和成本,选择合适的规模和设备,优化纯化的速度和效果。
这些原则可以帮助您设计出一个有效和高效的蛋白多级纯化方案,从而达到您所需的纯度和产量。
公众号推送的部分图片文字来源于期刊或其他公众号平台,目的在于分享行业相关知识、传递最新资讯。文章版权属于原作者所有,如有侵权,请及时告知,我们会及时删除相关信息。
咨询
- 182
- 点赞
- 复制链接
- 举报