研究了百余年的胆汁酸,新的突破点在哪里?
得益于麦特绘谱科研团队多年来的探索与成果积累,我们拥有最全最成熟的胆汁酸谱检测技术,并已积累了上万例样本的项目经验。
胆汁酸(Bile Acid, BA)是胆汁的主要成分,一方面促进肠道对脂类营养物质的吸收,另一方面具有信号分子功能,在糖脂代谢、能量消耗、机体免疫等诸多生理功能中均具有重要的调控作用。
胆汁酸研究的历史起源
尽管首次对胆汁的书面记录可追溯到古埃及时期(公元前1550年),但希波拉底时期(公元前460-377年)其作用才得以突显,被认定为四大体液之一,而协调四种体液是当时主要的疾病治疗方式,也是中医的基石之一。直到19世纪下半叶,BA才被分离出来,但在BA领域取得的最大成就是在20世纪,BAs化学结构被解析出来。随后陆续有更多突破性发现:
1943年,研究发现BA是由胆固醇生成;
1950s,BAs色谱分离,次级BA及肠肝循环被发现;
1970s,UDCA和CDCA用于治疗胆固醇结石;
1980s进入了BA合成和代谢领域。
1989-1990年,BA合成限速酶CYP7A1被分离出,开启了BA代谢的分子时代。
1999年,法尼醇X受体(FXR) 被确定为第一个胆汁酸激活受体;
2002年,次级BA激活受体G蛋白偶联胆汁酸受体1(GPBAR1, 也称TGR5)被确定,BA复兴时代到来;
2005年后,肠道菌群的引入为BA研究又开辟了一条新道路。
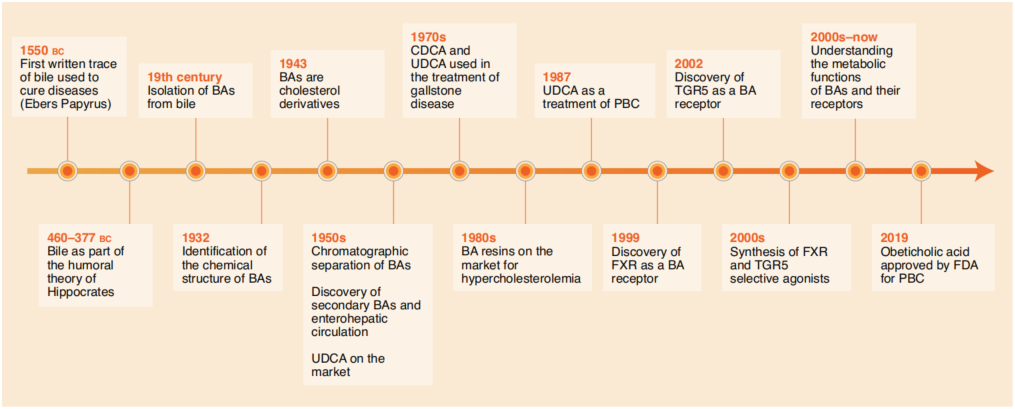
图1. 胆汁酸领域的重大发现时间表
胆汁酸的合成与转化
不同体液和组织中胆汁酸的相对组成存在较大差异,这些差异主要因为BAs合成、分泌、转化及体循环等过程,同时,肠道微生物也影响宿主胆汁酸池组成。在回肠末端,约95%BAs通过位于肠上皮细胞管腔侧的顶端钠依赖性胆汁酸转运体(SLC10A2或ASBT)进行重吸收。在肠细胞中,BAs被肠道胆汁酸结合蛋白(FABP6或IBABP)结合,并通过有机溶质转运体复合体被运送到细胞的基底侧膜,释放到门脉循环中。随后通过门脉循环转运回肝细胞的基底膜,然后被牛磺胆酸钠共转运多肽(SLC10A1或NTCP)和有机阴离子转运多肽(SLCO或OATP)家族的成员所摄取。一旦进入肝细胞,BAs就参与7α-羟化酶 (CYP7A1) 和固醇 12α-羟化酶 (CYP8B1)对胆汁酸合成的调节,将新合成BAs整合到现有的BAs池。维持胆汁酸池的稳定,这对适当的营养吸收和维持肠道微生物群稳态至关重要。事实上,胆汁酸池组成的紊乱出现在多种疾病中,包括不同来源的腹泻、吸收不良、炎症性肠道疾(IBD)、血脂异常、动脉粥样硬化、糖尿病和慢性肝病等。

图2. 肝脏和肠道中胆汁酸的合成和生物转化
胆汁酸受体
虽然过去的三十年中已经确定了几种BA受体,但FXR 和TGR5因其在健康和疾病中的调节作用而得到了特别充分的研究,并且它们的特性可以表征BAs在体外以不同效力结合并激活受体,不过这些受体在体内的激活很大程度上取决于BA池总组成。FXR广泛存在于体内各脏器及组织,其中以肝脏和肠道中表达量最高。CDCA是一种天然的FXR激动剂,与类视黄醇X受体α(RXRα)复合物结合,激活其靶基因的转录。TGR5是GPCR中视紫质样亚家族的成员,几乎所有组织中都有表达,其中胆囊上皮细胞含量最丰富。次级BAs是TGR5最有效的激动剂,它们与牛磺酸或甘氨酸的结合进一步增加了激活效果。因此,BAs是FXR和TGR5的双激动剂,两者经常在多个器官中互补,共同调节全身代谢。
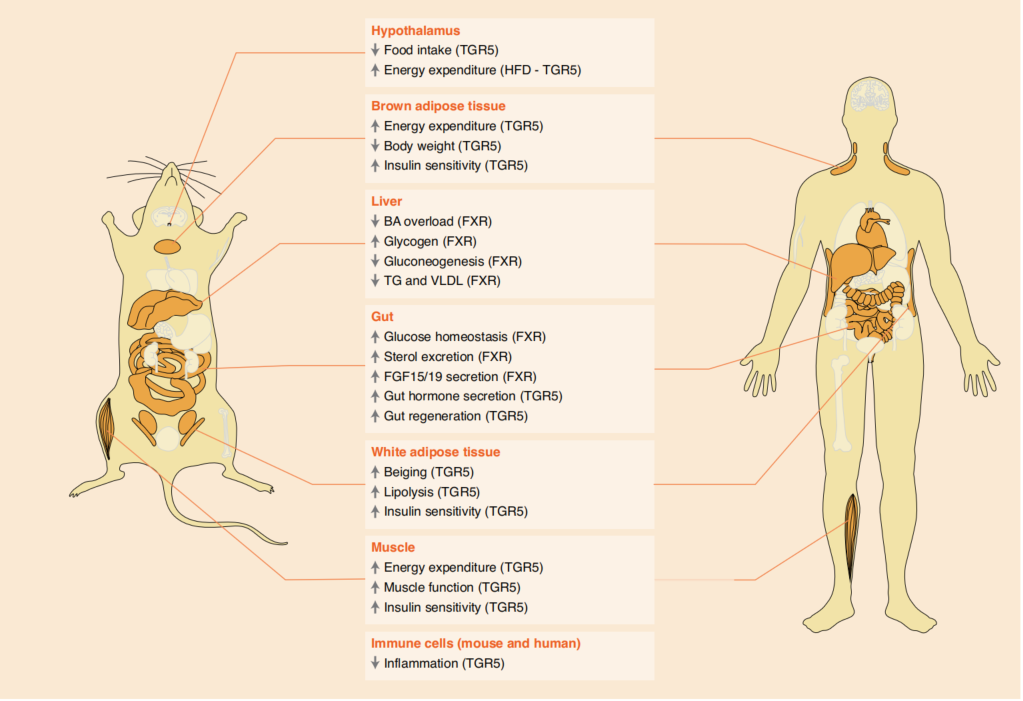
图3. 胆汁酸的靶组织和生物活性
大量研究表明,通过改变饮食、运动、寒冷暴露、抗生素、益生菌或粪便移植等来调节外周胆汁酸池的大小和组成,可能是调节能量稳态的一个有前途的策略。靶向肠道微生物-胆汁酸轴在治疗多种疾病中表现出巨大的潜力,但深入认识其机制联系以及转化为临床实践还有很长的路要走。此外,许多基于临床前模型和多种疾病患者的研究已详细描述了胆汁酸及其受体的功能,而胆汁酸信号通路的很多方面仍需更多研究。

图4. FXR在各组织中的信号转导及其生理/药理作用
胆汁酸谱分析
得益于麦特绘谱科研团队多年来的探索与成果积累,我们拥有最全最成熟的胆汁酸谱检测技术,并已积累了上万例样本的项目经验。该方法采用60+种胆汁酸标准品建立绝对定量标准曲线,以稳定同位素标记胆汁酸作为内标,实现60+种胆汁酸的精准定量,并确保多种同分异构体均获得较好分离。
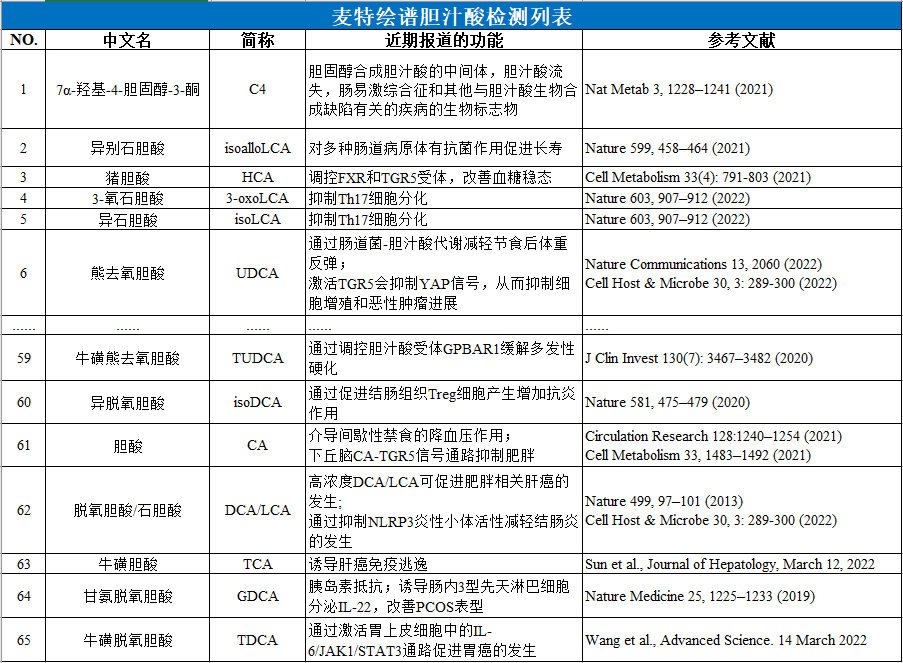
目前,麦特绘谱与合作伙伴已发表多篇胆汁酸相关文章,发表期刊包含Cell Metabolism、Nature Communications、Advanced Science、Diabetes Care、Microbiome、Science Advances等,涵盖肝病(慢性肝病与肝癌)、胆道疾病、胃肠道疾病、神经系统疾病、心血管疾病、糖尿病、肥胖与减重等领域。
胆汁酸研究的高端“利器”,麦特绘谱胆汁酸谱福利活动火热进行中!超值特惠,不容错过!欢迎咨询,了解详情。

参考文献
1. Metabolic Messengers: bile acids. Nature Metabolism. 2022.
2. Bile acids and their receptors in metabolic disorders. Progress in Lipid Research. 2021.
3. Gut microbiota-derived bile acids in intestinal immunity, inflammation, and tumorigenesis. Cell Host & Microbe. 2022.
咨询
- 193
- 点赞
- 复制链接
- 举报










