间充质干细胞治疗新型冠状病毒肺炎专家共识
一、概 述
新型冠状病毒肺炎(coronavirus disease 2019,COVID-19) 是由新型冠状病毒(severe acuterespiratory syndrome coronavirus 2, SARS-CoV-2)感染导致的肺炎。根据国家卫生健康委员会和国家中医药管理局联合发布的《新型冠状病毒肺炎诊疗方案(试行第八版)》[1],根据病情严重程度可分为轻型、普通型、重型和危重型。患者主要临床表现为发热、乏力、干咳,少数患者伴有鼻塞、流涕、腹泻等症状。重症患者多在发病 1 周后出现呼吸困难和(或)低氧血症,严重者可快速进展为急性呼吸窘迫综合征(acute respiratorydistress syndrome, ARDS)、脓毒症休克、难以纠正的代谢性酸中毒、出凝血功能障碍及多器官功能衰竭等。我国已将 COVID-19 纳入《中华人民共和国传染病防治法》规定的按照甲类传染病管理的乙类传染病。2020 年 1 月 30 日,WHO 将COVID-19 列为国际关注的突发公共卫生事件,并于 2020 年 2 月 28 日将其传播和影响的风险评估提高到最高等级。COVID-19 作为亟待解决的重大公共卫生事件,急需寻找安全有效的治疗手段 [2]。
SARS-CoV-2 是有包膜的单股正链 RNA 病毒,呼吸道飞沫和密切接触是其主要的传播途径,接触病毒污染的物品也可造成感染。病毒的S 蛋白通过与靶细胞表面的血管紧张素转化酶 2(angiotensin-converting enzyme 2, ACE2)结合而进入细胞内进行复制和扩散 [3]。感染 SARS-CoV-2后,多数患者预后良好,少数患者病情危重,多见于老年人、有慢性基础疾病者、晚期妊娠和围产期女性、肥胖人群等。造成患者肺组织损伤的主要原因包括:①病毒感染直接引起的病理改变,包括肺泡细胞肿胀、坏死、脱落等导致的肺泡上皮细胞损伤;②机体抗病毒免疫反应引起的严重免疫紊乱,这在重型和危重型患者体内表现尤为明显。COVID-19 的病理表现为:肺泡腔内纤维素性渗出物聚集,巨噬细胞和淋巴细胞浸润,肺泡间质淋巴细胞浸润,导致肺泡毛细血管通透性增加,肺透明膜形成,肺泡壁和细支气管管壁纤维素性坏死 [4-5]。肺脏毛细血管内皮细胞及肺泡上皮细胞的弥漫性损伤,会进展为 ARDS。除肺部病理损伤外,COVID-19 患者尤其是重症患者外周血中淋巴细胞数量减少、血浆炎症因子水平显著升高[6],最后会导致休克及多器官功能障碍甚至死亡 [7-8]。
COVID-19 的临床诊治主要依据《新型冠状病毒肺炎诊疗方案(试行第八版)》[1]。主要治疗手段包括对症治疗、抗病毒治疗、呼吸支持治疗、免疫治疗以及中医药治疗等。由于 SARS-CoV-2 系新发病毒,目前尚无特效的抗病毒药物。前期研究显示,洛匹那韦 / 利托那韦、瑞德西韦等抗病毒作用有限[9-10]。对于重型与危重型患者,应积极防治并发症,及时进行呼吸支持治疗。中医治疗方面可根据患者病情、体质因素以及当地气候等进行辨证论治。
免疫治疗的目的是遏制炎症细胞的聚集性浸润、降低炎症因子水平和恢复免疫系统平衡。当前,免疫治疗方法主要包括:①针对炎症因子效应的抗炎症因子治疗。目前 IL-1 家族阻断剂、抗 IL-6抗体等正处于临床试验阶段 [11-12]。针对机体系统性免疫紊乱与耗竭,也有利用抗 PD-1 单克隆抗体等免疫检查点抑制剂来逆转 COVID-19 免疫耗竭的临床研究。②康复者恢复期血浆治疗。抗病毒中和抗体通过与 SARS-CoV-2 表面蛋白相结合,可有效阻止 SARS-CoV-2 感染细胞 [13],已成为有效控制病毒复制、短期内迅速改善症状的重要手段 [14]。③干细胞治疗。COVID-19 疫情爆发以来,国内外已有多个团队完成了干细胞治疗 COVID-19的I期和II期临床试验,III期临床试验正在进行中。现有结果表明,间充质干细胞(mesenchymal stemcell, MSC)治疗 COVID-19 安全性良好,在缩短病程、减轻肺部损伤、降低炎症因子水平等方面显示出较好的临床疗效 [15-19]。
二、MSC 治疗 COVID-19 的科学依据
MSC 是一群来源于中胚层的多能干细胞,具有多向分化、促进组织器官修复和免疫调控等潜能。MSC 可从骨髓、脐带、胎盘、脂肪、骨骼、牙髓和子宫内膜等多个组织中分离,MSC 样细胞也可由胚胎干细胞或多能干细胞分化而来 [20-21]。MSC 具有低免疫原性,因不表达 CD40、CD80、CD86 等共刺激分子和主要组织相容性复合体Ⅱ类分子,所以引起免疫排斥反应的可能性较小 [22]。同时因其对免疫细胞的调节效应不受主要组织相容性复合体分子的限制,对自体和异体的免疫细胞都可发挥免疫调节效应。MSC 还具有炎症趋化特性,通过感知炎性信号(细胞因子、趋化因子受体和整合素等)而迁移至炎症部位,依赖细胞间直接接触和(或)旁分泌效应而发挥作用 [23],如 MSC 可通过细胞间直接接触或分泌细胞因子的方式对激活的 淋巴细胞、B 淋巴细胞、自然杀伤细胞、树突状细胞等的增殖、分化和抗体产生等发挥调控效应[24]。
有研究显示,外周静脉输入 MSC 后,1 h 内约50% ~ 60% 的细胞停留在肺组织内,3 h后数量降至约0%,48 h后 MSC 会在肝脏和脾脏内聚集,10 d 后仍可检测到细胞滞留[25]。MSC聚集在肺组织可分泌细胞营养因子如角质形成细胞生长因子(keratinocyte growth factor, KGF)、血管内皮生长因子(vascular endothelial growth factor, VEGF)和肝细胞生长因子(hepatocyte growth factor, HGF)等,促进 II 型肺泡上皮细胞再生,改善肺部微环境,促进 ARDS 损伤后肺泡上皮屏障的修复 [21]。
目前已开展了多项 MSC 治疗肺损伤的临床研究。其中已报道的 MSC 治疗 ARDS 的临床研究超过 15 项,患者多为需要机械辅助通气的危重型呼吸衰竭患者 [26-29]。输注细胞剂量从 1×106 cells/kg 至1×107 cells/kg 不等,输注途径以外周静脉为主 [30]。临床研究中未观察到明显不良反应。在肺部渗出明显阶段,MSC 有助于改善氧合指数,降低肺部的炎性损伤,提示 MSC 治疗对 ARDS 有一定的治疗作用。除 ARDS 外,也开展了多项 MSC 治疗特发性或放射性损伤引起的肺纤维化的临床研究 [31-32],初步结果显示患者耐受性良好,细胞治疗后纤维化无明显进展,6 个月后各项肺功能指标稳定。对于 H1N1、H5N1 和 H7N9 等病毒感染引起严重肺损伤疾病,MSC 可作为控制炎症、改善肺损伤的重要辅助手段 [33-35]。
三、MSC 治疗 COVID-19 的临床研究进展
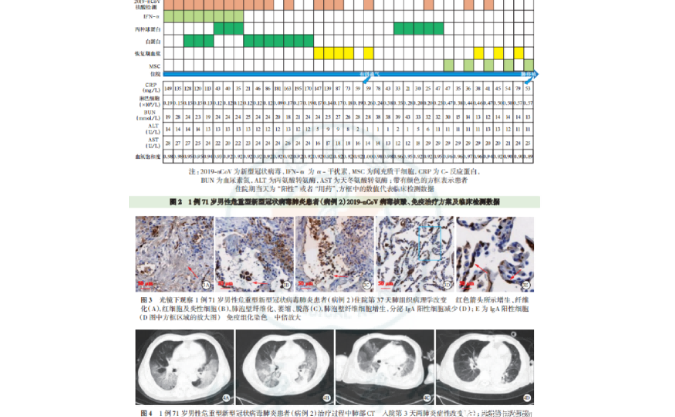
目前,国内外已完成多项 MSC 治疗 COVID-19的临床研究,超过 10 项研究结果已发表。李兰娟等 [36] 报道,2 例重症患者接受每次 1×106 cells/kg剂量、连续 3 次、间隔 1 ~ 3 d 的冻存宫血 MSC输注后,患者外周血淋巴细胞数量升高,炎症指标(IL-6 和 C 反应蛋白)降低,肺功能改善,双侧肺渗出病灶吸收。赵春华等 [37] 报道,7例普通型、重型和危重型患者接受单次 1×106 cells/kg MSC 输注后,所有患者在治疗后 2 d 症状明显缓解。3 例患者包括 2 例普通型和 1 例重型患者在治疗 10 d后出院。西班牙 Sanchez-Guijo F 等 [38] 报道,13 例重型和危重型患者接受每次 1×106 cells/kg 剂量、1 ~ 3 次脂肪 MSC 输注后呼吸状况改善,炎症因子水平降低。冯干珠等 [39] 报道,41 例重型和危重型患者接受单次 2×106 cells/kg 脐带 MSC 输注后可获得更快的临床改善。胡敏等 [40] 报道,1 例重症患者接受 5×107 cells/ 次、连续 3 次、间隔 3 d脐带来源 MSC 输注后,炎症指标降低,胸部 CT影像学改善。伊朗 Hossein Baharvand 等 [41] 报道,11 例 因 COVID-19 诱 发 ARDS 的患者接受2×108cells/ 次、连续3 次、间隔2 d脐带或胎盘MSC输注后呼吸窘迫症状缓解,炎症因子水平降低。胡宝洋等[42-43]报道了一项纳入27例发生肺纤维化 COVID-19 患者的非随机、开放 I 期临床研究,发现每次 3×106 cells/kg、1~3 次人胚胎干细胞来源的基质和免疫调节细胞(human embryonic stemcell–derived immunity-and matrix-regulatory cells,ESC-IMRCs)输注可减轻肺纤维化程度。近期美国 Camillo Ricordi 等 [15] 报道了一项纳入 24 例危重型 COVID-19 相关 ARDS 患者的随机、对照、双盲研究,(10±2)×107 cells/ 次、连续 2 次、间隔 3 d 的脐带 MSC 输注能显著改善患者存活率并缩短治疗时间。王福生等 [16-17] 报道了脐带 MSC 治疗 COVID-19 的临床Ⅰ期和Ⅱ期研究:Ⅰ期结果显示,3×107 cells/ 次、连续 3 次、每次间隔 3 d 的脐带 MSC 输注对 9 例普通型和重型患者的安全性良好;在武汉地区开展的Ⅱ期多中心前瞻性随机双盲安慰剂对照临床研究中,共纳入 100 例重型患者,结果显示 4×107 cells/ 次、连续 3 次、间隔3 d 的脐带 MSC 输注可有效减少重型 COVID-19患者肺部损伤,改善患者活动耐力。
上述临床结果表明,普通型、重型、危重型的 COVID-19 患者接受不同来源的 MSC 治疗后均没有观察到与输注相关的不良反应,MSC 治疗有助于降低患者炎症因子水平、促进肺部损伤修复、提高活动耐力、缩短住院时间。
尽管已报道的多个临床研究结果初步证实了MSC 治疗 COVID-19 的安全性和有效性,但迄今接受 MSC 治疗的 COVID-19 患者数量有限,且各临床研究的 MSC 剂量和疗程不一。为了进一步规范和指导 MSC 治疗 COVID-19 的临床实践,提升COVID-19 的治疗水平,我们组织国内前期参与COVID-19 一线诊疗工作的专家,以及来自感染病学、干细胞生物学、呼吸与重症医学、影像学、病毒学、免疫学、统计学和药理毒理学等领域的权威专家共同商议,形成此共识。
四、MSC 治疗 COVID-19 的建议
(一)患者的选择 1. 患者入选标准
年龄 16 ~ 85 岁;临床分型为重型或危重型,分型标准依据《新型冠状病毒肺炎诊疗方案(试行第八版)》[1]。
2. 排除标准
①既往有肿瘤病史或现患肿瘤者,或病理检查证实有癌前病变者;②急性心肌梗塞活动期或急性脑梗塞活动期患者;③妊娠或哺乳期患者;④心理疾病病情控制不佳的患者;⑤酒精或药物成瘾者;⑥不能或不愿签署知情同意书或依从性差者;⑦合并活动性结核或流感病毒、腺病毒以及其它急性呼吸道病毒感染患者;⑧临床医生认为不适于干细胞治疗的其他患者。
(二)细胞输注准备
1. MSC 的采集、制备和质量控制
干细胞供者筛选应建立并执行评估标准,样本采集必须得到供者或其法定代表人、监护人的同意,签署知情同意书,并经伦理委员会批准;干细胞制备过程和质量控制应按照《药品生产质量管理规范》(GMP)要求严格执行。建议在开展临床治疗项目前将 MSC 制剂送交中国食品药品检定研究院等行业认可的第三方机构进行质量复。具体规范和建议参见附件 1。
2. MSC 的准备
冻存细胞与新鲜培养细胞均可用于临床治疗。冻存细胞需提前做好复苏准备。输注前应仔细检查细胞袋外包装的完整性、生产(冻存)日期等信息。冻存细胞输注时首先确定好输注时间,细胞应在 30 min 内完成复苏、药物配伍流程并开始输注至患者体内,细胞输注应在 2 h 内完成。
3. MSC 输注方法
①推荐剂量为每次 1 ~ 3×106 cells/kg,每次间隔 3 ~ 7 d,共进行 3 次输注。②推荐使用输血过滤器进行输注,选取患者手臂较粗的静脉血管输注。③每袋细胞输注前轻轻颠倒数次,使细胞悬浮均匀。④输注前 10 min 缓慢静滴(20 ~ 30 滴 / min),10 ~ 15 min 后如无特殊反应,可将滴速调整为40 ~ 50 滴 / min,直至输注完成;若患者伴有心血管疾病,则应按医嘱控制滴速。⑤完成全部细胞输注后,用 10 ~ 30 ml 生理盐水冲洗输注袋。⑥输注完成后需密切观察患者生命体征。⑦对高度过敏体质患者建议输注细胞前使用甲基强的松龙(40 mg)预防过敏反应。
(三)细胞输注的监测和不良反应处理
1. 治疗前准备
干细胞输注前 72 h 内应完善血常规、肝肾功能、C 反应蛋白、炎症因子相关指标(IL-6、IL-8、TNF-α 等)、凝血功能、降钙素原、血气分析、心脏功能、心电图和胸部 CT 检查等;详细询问并记录患者既往病史、过敏史等情况。
2. 治疗过程监测
应在心电监护和经皮血氧饱和度监测下进行细胞输注,并做好急救措施准备。少数患者可能出现一过性的胸闷、自觉发热等不适,一般可自行缓解。如胸闷症状持续,应及时停止细胞输注,给予吸氧和生命体征监测,完善心电图、血气分析等检查,必要时对症处理。
3. 治疗后监测和处理
根据 MSC 细胞治疗其他疾病的报道和治疗COVID-19 的临床试验数据,目前其在临床应用中尚未发现严重的不良事件 [16,44-48]。已经报道的安全性事件主要是细胞输注后低热和恶心,多为自限性,一般在 24 h 内缓解。个别患者可能出现高热,可给予物理降温及对症药物治疗。但仍不排除存在输液反应、过敏性休克等可能,一旦出现应积极对症治疗。MSC 最后一次输注完成后 3 ~ 7 d 应复查血常规、肝肾功能、C 反应蛋白、降钙素原IL-6、血气分析和心脏功能等,对于治疗前存在明显肺部病变患者可复查胸部 CT。目前尚未发现与MSC 细胞治疗直接相关的远期不良事件,但仍建议在治疗后 1 ~ 2 年内定期检查血常规、肝肾功能、血糖、血脂、腹部彩超、胸部CT、心电图和肺功能等。
(四)疗效评价指标
评价指标包括:①临床症状评价:气短或呼吸困难可采用 mMRC 呼吸困难量表(见附件 2)进行评估,临床综合情况可采用 WHO 临床过程综合评分(见附件3)进行评价[49]。②实验室检测指标:血常规、血气分析、氧合指数(PO2/FiO2)、C 反应蛋白、炎症因子相关指标(IL-6、IL-8、TNF-α等)、淋巴细胞数量和亚群、乳酸脱氢酶、肝肾功能、D- 二聚体、凝血功能、心肌酶等。③胸部影像学评价:建议进行高分辨胸部 CT 检查,对病变范围和特征等进行评估,可采用 CT 总严重程度评分(total severity score, TSS)等指标辅助判断[17]。④肺功能评价(出院后随访):在医疗条件和患者身体状况允许的情况下,可进行肺功能评价[50],主要包括限制性通气功能障碍、肺弥散功能和气道阻塞相关指标。⑤临床转归评价标准建议参考《新型冠状病毒肺炎诊疗方案(试行第八版)》[1]。
五、实施要求
基于上述共识并结合 MSC 治疗 COVID-19 的前期研究结果,为了提高 COVID-19 的救治效果、减少并发症,建议在 COVID-19 定点收治医院并按照国家有关管理办法开展 MSC 治疗。相关标准可参照《药品管理法》和国家食品药品监督管理总局颁布的《药品注册管理办法》,或原国家卫生和计划生育委员会和原国家食品药品监督管理总局联合定的《干细胞临床研究管理办法(试行)》执行。利益冲突 所有作者均声明不存在利益冲突共识制定专家名单(以姓氏笔画为序):王福生(国家感染性疾病临床医学研究中心主任,解放军总医院第五医学中心感染病医学部主任)、王贵强(北京大学第一医院感染科兼肝病中心主任,中华医学会感染病学分会前任主委)、王霄英(北京大学第一医院影像科主任)、石磊(解放军总医院第五医学中心感染病医学部生物损伤救治科副主任)、刘中民(上海市东方医院院长)、孙云霞(北京昭衍新药研究中心股份有限公司副总经理)、李元元(解放军总医院第五医学中心感染病医学部副主任医师)、李太生(中华医学会传染病学分会主任委员,北京协和医院感染内科主任)、李永纲(解放军总医院第五医学中心感染病医学部副主任)、吴朝晖(中国医药生物技术协会驻会副理事长)、吴尊友(中国疾控中心流行病学首席专家)、张文宏(复旦大学附属华山医院感染科主任,中华医学会传染病分会副主委)、张宇(中源协和副总经理兼首席科学官)、苑鑫(解放军总医院第五医学中心感染病医学部呼吸与危重症医学科主任)、周琪(中国科学院副院长,北京干细胞与再生医学研究院理事长,中国科学院动物研究所研究员)、孟淑芳(中国食品药品检定研究院生物制品研究所细胞室主任)、孟繁平(解放军总医院第五医学中心感染病医学部生物损伤救治科副主任)、项春生(浙江大学传染病诊治国家重点实验室副主任,国家干细胞临床研究专家委员会委员)、赵春华(北京协和医学院细胞生物学系主任、中国医学科学院组织工程研究中心主任,国家干细胞临床研究专家委员会委员)、胡豫(华中科技大学同济医学院附属协和医院院长)、施明(解放军总医院第五医学中心感染病医学部研究所所长)、姚晨(北京大学第一医院医学统计室主任,北京大学医学院临床研究所副所长)、徐哲(解放军总医院第五医学中心感染病医学部生物损伤救治科主任)、徐若男(解放军总医院第五医学中心感染病医学部副研究员)、高晨燕(国家药品监督管理局药品审评中心生物制品临床部部长)、黄磊(解放军总医院第五医学中心感染病医学部感染性疾病科主任)、韩为东(中国研究型医院学会生物治疗学专业委员会主任委员,解放军总医院第五医学中心肿瘤医学部生物治疗科主任)、程涛 [ 中国医学科学院血液病医院(血液学研究所)所院长 ]、谢渭芬(海军军医大学长征医院消化内科主任医师)、福军亮(解放军总医院第五医学中心感染病医学部感染性疾病科副主任)、魏于全(华西医院临床肿瘤中心主任,生物治疗国家重点实验室主任,国家干细胞临床研究专家委员会委员)
摘自毕特博生物公众号
咨询
我们尊重知识产权,如您认为本平台所载文章、图片、视频等内容侵犯您的合法权益,请您及时联系我们,我们将依据相关法律法规、平台规则予以处理。
关键字
- 310
- 点赞
- 复制链接
- 举报