CD8+T细胞前世今生,为什么在肿瘤中的他们的功能会失调
- CD8+T 细胞的前世今生
什么是CD8+T细胞?
系细胞表面表达CD8分子的T细胞,这些细胞会识别由8~10个氨基酸残基组成的抗原肽(受自身MHCI类分子的限制),并在活化后分化为细胞毒性T细胞(CTL),杀伤被病原体寄生的细胞或肿瘤细胞。
CD8+T细胞起源于何处?
所有T细胞均起源于从骨髓迁移至胸腺的淋巴样祖细胞。胸腺容纳尚未成熟的T细胞,尚未发育出抗原识别所需的T细胞受体。在感染过程中,最初的CD8+T细胞最初是通过与淋巴器官内的APC相互作用来刺激的。
CD8+T细胞发育
一旦未成熟的T细胞迁移到胸腺,它们就准备发展成CD8+细胞。祖T淋巴细胞首先经历了许多DNA重排,这些重排产生了多种TCR,这些TCR能够识别来自外源或细胞内病原体的抗原。TCR多样性取决于TCR基因的随机DNA重排数目,这些重排导致独特的抗原特异性受体的表达。一旦确定了CD8之类的TCR功能稳定,未成熟的T细胞就准备好进行称为克隆选择的抗原介导过程。当TCR与胸腺细胞呈递的MHC I类蛋白质复合时,抗原结合抗原时,便开始进行阳性选择。如果该结合事件对于CD8成功,则新激活的CD8+T细胞将继续分化为成熟的CTL。在此阶段无法与抗原-MHC I类复合物充分结合的未成熟T细胞将发生凋亡。当未成熟的T细胞与自身抗原的结合太强时,就会发生阴性选择。对阴性选择的T细胞进行编程以使其发生凋亡,从而消除了它们对健康细胞进行自身反应的能力。
CD8+T细胞活化
经历阳性选择的幼稚CD8+T细胞需要额外的信号传导过程来确定其命运。例如,CD4+辅助性T细胞可以调节APC,以向幼稚CD8+T细胞提供更强的抗原信号。辅助性T细胞或树突状细胞(Dendritic cells,DC)也可以通过共刺激信号(例如CD80/86以及细胞因子IL-12)介导细胞毒性T细胞活化。使用共刺激性T细胞辅因子同时激活TCR,可使激活的CD8+T细胞增殖为包含效应和记忆T细胞类型的扩展群体。阳性选择的CD8+T细胞向高度特异性CTL的扩增是克隆选择的最后一步。
细胞毒性T细胞有什么作用?
一旦CD8+T细胞被激活,它们将经历一连串的复制和分化步骤,从而引发它们的定向免疫应答。与靶向感染或恶性细胞物理接触的CTL诱导凋亡,这是一种通过细胞毒性酶和分子进行的程序性细胞死亡形式。
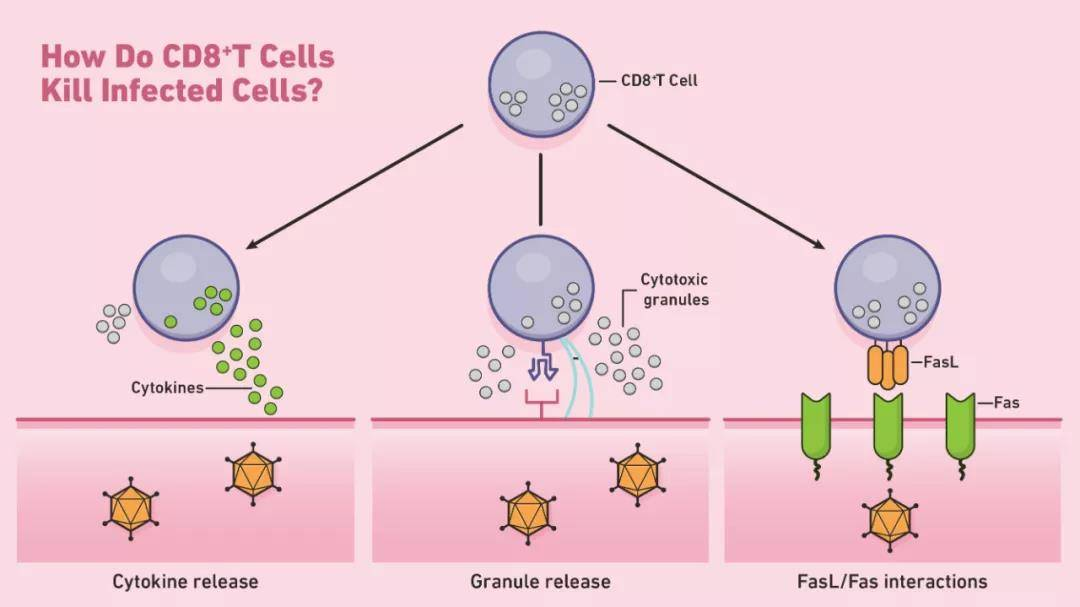
CD8+T细胞如何杀死感染的细胞示意图。
CD8+T细胞启动凋亡的一种方式是通过穿孔素和颗粒酶(两种类型的细胞毒性蛋白)的分泌。穿孔素是在靶细胞的细胞膜上形成孔的溶细胞蛋白。CTL使用这些孔来引导粒酶的释放,粒酶是一类丝氨酸蛋白酶,可继续在细胞质内凋亡。这些蛋白酶通过裂解参与正常细胞维持的病毒和细胞蛋白来关闭靶细胞。然后,经历凋亡的靶向细胞被附近的吞噬细胞清除。CTL还可以通过Fas-Fas配体相互作用诱导细胞凋亡。每当Fas配体(Fas ligand,FasL)与靶细胞上的Fas受体结合时,一系列信号分子就会通过激活caspase蛋白酶(cysteinyl aspartate specific proteinase,含半胱氨酸的天冬氨酸蛋白水解酶)来启动细胞凋亡。这些蛋白酶在细胞凋亡的后期进行大部分的蛋白水解。
除定向凋亡外,CD8+T细胞还可以通过释放诸如TNF-α的细胞因子来间接杀死靶细胞。例如,类型1 CD8+T细胞(Tc1)可以释放IFN-γ ,这是一种能够抑制病毒复制并增强特定抗原呈递的细胞因子。在其主要反应结束时,活化的CD8+T细胞通常会因凋亡而死亡。
二.为什么在肿瘤环境中CD8+T细胞功能会失调
CD8+T细胞可以选择性杀死肿瘤细胞。肿瘤相关抗原包括肿瘤因突变等原因产生的特异性新抗原和自身抗原。CD8+T细胞可以识别这些抗原,诱导抗肿瘤反应。但是尽管如此,生长的肿瘤和T细胞可以共存,这样的共存也发生在高免疫原性的肿瘤中。这一现象被称为“Hellstrom paradox”。这也表明肿瘤反应性CD8+T细胞抗肿瘤反应出现功能障碍。
目前对CD8+T细胞的功能障碍的研究大多来自于分离的肿瘤浸润T细胞,这些细胞会对肿瘤抗原产生反应性,但是会表达多种抑制性受体,如PD-1 LAG3 TIM3 CTLA4,不能产生效应细胞因子与细胞毒性分子如颗粒酶和穿孔素。有多种术语可以描述T细胞功能失调,包括“无能”“耐受”“耗竭”T细胞,表示细胞处于低反应性状态。
CD8+T细胞低反应性状态
CD8+T细胞的分化是一个被严格调控的过程。抗原性质、持续时间等决定CD8+T细胞分化轨迹,导致T细胞状态变化,从功能性效应T细胞(急性感染、自身免疫或移植物抗宿主反应)到低反应性T细胞状态(肿瘤、慢性感染以及耐受)。不同的转录特征和表观遗传决定了CD8+T细胞功能状态。
Tolerance 耐受状态:耐受是指T细胞对自身抗原反应迟钝,防止自身免疫,通过中枢耐受和外周耐受产生。幼稚T细胞在遇到自身抗原时不能完全激活,会导致细胞凋亡。外周T细胞遇到自身抗原则不会产生效应细胞因子或增殖。在过去的几十年间,肿瘤抗原一直是抗肿瘤免疫的主要靶点。与自身T细胞相比,肿瘤抗原特异性T细胞不受中枢和外周耐受机制的控制,理论上来讲抗肿瘤反应更加显著。在肿瘤早期发展阶段,组织处于非炎症环境,T细胞状态类似于外周耐受状态。而进展中的肿瘤内的T细胞显示出的特征与肿瘤抗原特异性T细胞功能障碍相似。在免疫治疗干预或者临床治疗时,是自身T细胞还是肿瘤抗原特异性T细胞主导了对于治疗的反应性还未知。
Exhaustion耗竭一词最初用于描述在慢性低反应性中T细胞的状态。在慢性感染期间,T细胞受到抗原的长期刺激,导致细胞的效应逐渐丧失,多种抑制性受体表达上调。肿瘤进展期或者晚期,T细胞与肿瘤抗原持续接触,反应性变得迟钝,与慢性感染中的T细胞有多种关键特征类似。因此耗竭已经用来描述肿瘤中T细胞功能障碍。
肿瘤诱导的CD8+T细胞功能障碍
肿瘤诱导的CD8+T细胞功能障碍是由免疫抑制性肿瘤微环境导致的,包括髓系来源的抑制性细胞、肿瘤相关巨噬细胞以及调节性T细胞,还包括IL10 TGFb和免疫抑制检查点等。小鼠模型和人肿瘤研究表明致癌途径和肿瘤抑制途径可以塑造固有和适应性免疫细胞的募集、激活以及反应性。肿瘤抗原特异性CD8+T细胞激活不足以及肿瘤中免疫浸润不良是肿瘤重要的免疫逃逸机制,这样的肿瘤被称为“冷肿瘤”。这一过程分为两个阶段。阶段一为初始肿瘤抗原产生与早期功能障碍。在肿瘤发生的早期阶段即癌前病变阶段,细胞突变会产生新抗原。由于发生转化的细胞数量较少,这导致T细胞的激活不充分,细胞分化为低反应性状态。而在急性病原感染时,病原体抗原水平较高,T细胞的激活很充分,与肿瘤组织T细胞形成鲜明对比。阶段二为持续性抗原和TCR刺激与晚期T细胞功能障碍。T细胞的低反应性导致早期恶性病变进展到肿瘤阶段。肿瘤相关的抗原进一步得到积累,抗原异质性进一步增加。抗原-TCR持续刺激T细胞,驱使T细胞进入耗竭状态。肿瘤细胞生长状态不受控制,导致肿瘤进展,T细胞进入晚期功能障碍。晚期功能障碍T细胞与慢性感染中的病原体特异性T细胞有许多相似的表型特征,二者也存在明显差异。
肿瘤中T细胞功能障碍的机制
技术的进步已经让我们能够了解肿瘤中T细胞功能障碍的机制,包括单细胞转录组和表观遗传分析,TCR库、肿瘤免疫分析以及CRISPR的应用等。本文章作者重点关注了T细胞分化和功能障碍的关键转录因子和关键调节分子。
肿瘤发生过程中T细胞分化过程:虽然早期和晚期肿瘤特异性T细胞的细胞毒性能力都会受损,早期功能失调的T细胞可以恢复效应功能,晚期T细胞功能障碍不能恢复。早期和晚期功能障碍T细胞可以通过表面蛋白表达不同来区分。PD-1和LAG3可以表达在早期和晚期功能障碍T细胞上。晚期功能障碍T细胞还会表达其他抑制性受体,如CD38 CD39 CD101和TIM3。早期和晚期功能障碍的T细胞的染色质可及性模式也不同,这些变化在小鼠肿瘤模型和人肿瘤中得到验证,并且研究发现肿瘤免疫检查点治疗或许不能改变细胞的表观遗传模式。
早期T细胞功能障碍的分子机制:为了有效激活CD8+T细胞,TCR和CD28共同激活MAPK JNK PI3K-AKT IKK通路。随后激活多种转录因子,包括NFAT和FOS-JUN二聚体(AP-1)。激活后的NFAT和AP-1共同参与效应靶基因IL2和IFNg的转录。而在没有共刺激分子激活的情况下,导致AP-1活性不足,NFAT则会与抑制性转录因子EGR2 EGR3 IKZF2 IRF4 TOX等以及其他负调节蛋白合作,促进T细胞功能障碍。分析染色质可及性也发现,NFAT在效应性CD8+T细胞和功能失调的肿瘤特异性CD8+T细胞中结合基序位点的开放性明显不同。
晚期T细胞功能障碍分子机制:早期T细胞功能障碍,细胞有少量或者几乎没有效应功能。到了晚期CD8+T细胞功能障碍,与慢性感染期间的CD8+T细胞相似,处于终末分化耗竭T细胞状态。晚期功能障碍T细胞和慢性感染中的CD8+T细胞有一个共同特征是表达TCF1的丧失,TOX高表达。并且研究表明细胞分化过程也与免疫记忆相关。
CD8+T细胞效应功能丧失机制:CD8+T细胞不能消除肿瘤有多种机制涉及其中。这其中包括T细胞外机制,包括肿瘤细胞介导的MHC表达丢失、抗原丢失、抑制性受体表达;肿瘤微环境介导的TGFb IL-10以及调节性T细胞和MDSC。缺乏抗肿瘤反应的T细胞也是由于T细胞内在的细胞毒性功能受损。研究发现细胞毒性分子可以合成,但未从细胞中释放出来。
组织驻留机制:肿瘤中的T细胞具有与组织驻留相关的分子表达模式。组织驻留记忆T细胞的主要特征是S1PR1表达下降,组织驻留标志物CD69 CD49a和CD103表达上升,还包括抑制性受体PD1 TIGIT TIM3和转录因子HOBIT BLIMP1 RUNX3表达上升。肿瘤浸润的驻留T细胞表达有CD103和抑制性受体。研究表明组织中浸润的CD103+CD8+T细胞的丰度与生存率呈正相关。CD103+CD8+T细胞被认为是比CD8+T细胞更准确的预后良好的标志物,并且与接受ICB治疗的黑色素瘤患者的生存率呈正相关。
咨询
- 232
- 点赞
- 复制链接
- 举报