新冠病毒突变株介绍-上部
新冠病毒(SARS-CoV-2)的突变是病毒的进化方式。在不破坏SARS-CoV-2关键生化表型的前提下,通过抗体靶向位点固定突变,引发抗原表位漂移,以逃避相关抗体的识别。目前,新冠病毒突变体已有数千种,主要流行突变株有α,β,δ等。
新冠病毒(SARS-CoV-2)的突变是病毒的进化方式。在不破坏SARS-CoV-2关键生化表型的前提下,通过抗体靶向位点固定突变,引发抗原表位漂移,以逃避相关抗体的识别。目前,新冠病毒突变体已有数千种,主要流行突变株有α,β,δ等。

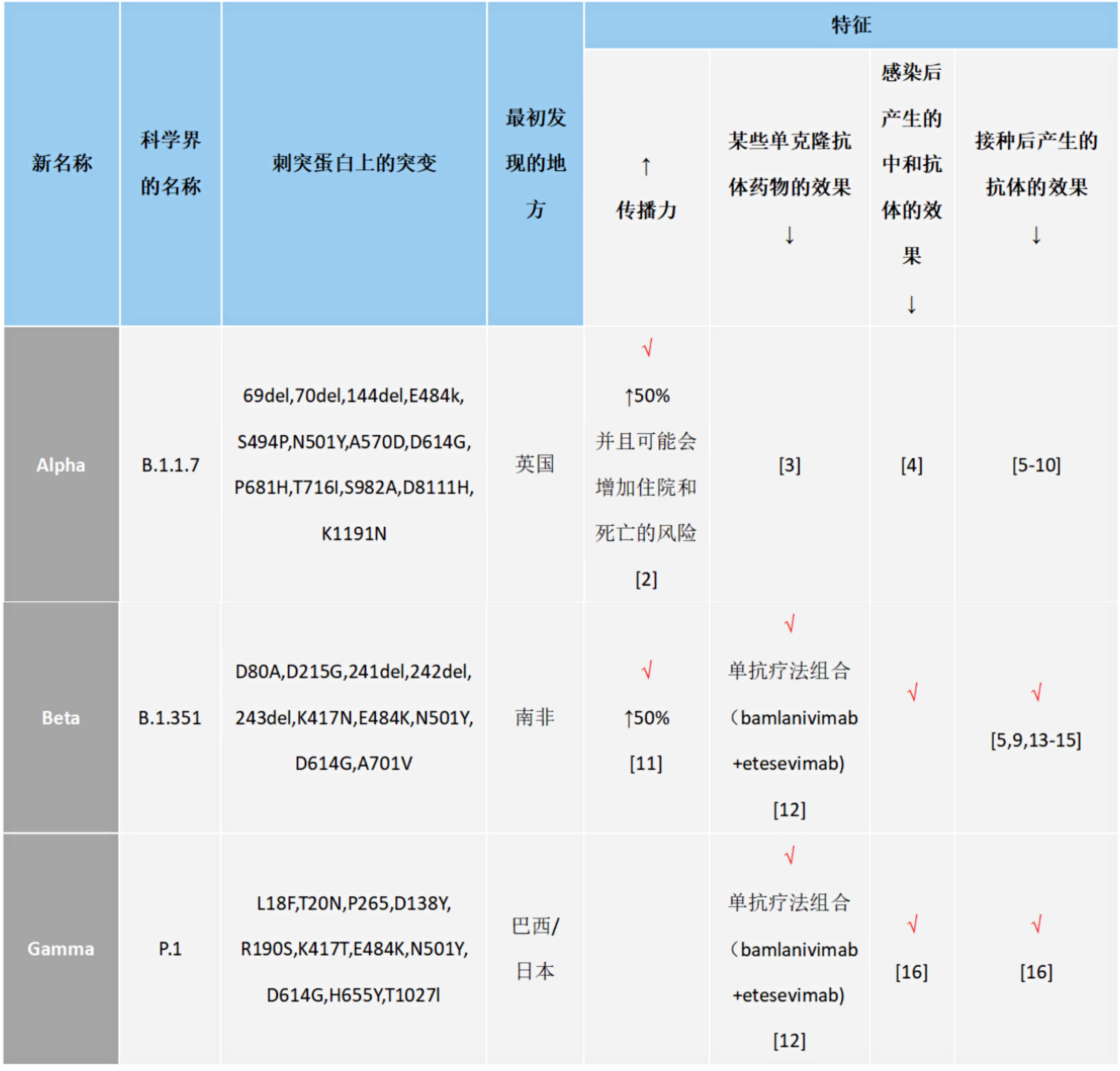
B.1.1.7突变毒株,又称20I/501Y.V1或VOC 202012/01,2020年12月在英国最早被发现,随后在美国、加拿大、日本等多个国家都报道了B.1.1.7谱系的病例。B.1.1.7突变毒株与人ACE2受体结合亲和力提高了1000倍, 传染能力是原始毒株的1.7倍。
B.1.1.7谱系在D614G突变的基础上一次性获得了17个突变位点,S蛋白上包含9个突变位点:1)位于S1 N末端结构域(NTD)的69-70, Y144位氨基酸缺失;2)位于受体结合域(RBD)上的N501Y突变;3)位于S1 C末端结构域的A570D, D614G, P681H;4)位于S2上的T716I,S982A,D1118H。
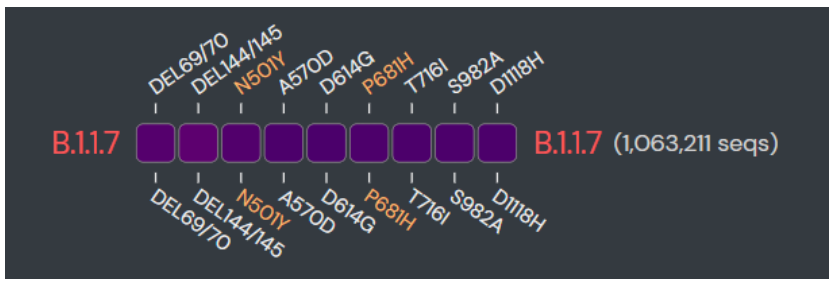
关键突变位点对SARS-CoV-2功能的影响
1.69-70del
该突变表现为新冠N端结构域(NTD)中H69和V70缺失,单一的H69/V70缺失并不常见,其常常伴随着RBD突变。除了B.1.1.7病毒株(N501Y+69-70del)外、丹麦水貂突变毒株(N439K+Y453F+69-70del)也呈现这种趋势。H69/V70缺失会使周围I68、S71、G72、T73、N74和G75向内移动形成突起环,并靠近NTD的结合表位。已有研究表明NTD中的H69/V70缺失可以逃避NTD特异结合中和抗体的途径,有利于病毒逃离宿主的免疫反应,但目前尚未明确免疫逃逸是由H69/V70缺失导致的NTD构象引起的。
2.D614G
突变D614G突变具有更强的感染性,目前是新冠突变毒株的主要形式。D614G突变会增加S1/S2交界处Furin蛋白酶切割效率。当D突变为G时,D614残基与相邻原聚体S2区域上T859残基形成的氢键消失,提升了Furin蛋白酶切割效率,使得S1蛋白更易从S2蛋白-病毒膜融合体上脱落,促进病毒膜融合进程,暗示D614G突变对宿主细胞具有更强或更快的感染力。同时,D614G还会改变RBD蛋白的构象去更好地与ACE2配位。D614毒株中,53%RBD聚体为全封闭,47%为单开放,40%的RBD处于“向上”状态;G614毒株中,5%为全封闭,36%为单开放,39%为双开放,20%为三开放,82%的RBD处于“向上”状态。这种更高的RBD状态“向上”的倾向以及更加开放的RBD聚体结构使得D614G突变更易与ACE2结合。
3.N501Y
N501位氨基酸是新冠病毒RBD蛋白的关键接触残基之一,直接参与RBD和ACE2的结合作用,而N501Y突变增强了RBD和ACE2的结合亲和力。N501属于亲水性残基,病毒结合ACE2时,N501靠近ACE2的Y41疏水苯环和K353疏水烷烃链;但当N501突变为疏水残基Y时,Y501则可以通过疏水作用与ACE2中的Y41和K353更好的配位,改善RBD和ACE2互作构象,将结合亲和力提高约0.81kcal/mol,同时使原来不感染小鼠的新冠病毒毒株获得感染能力。N501Y突变对于靶向RBD中和表位的中和抗体的结合效力影响较小。研究发现,N501毒株与中和抗体结合VH-Fc ab8后(该分子融合表达了可变重链区域VH和人类IgG1的Fc片段),S蛋白呈现两种构象即两个RBD分子处于“向上”位置和仅有一个RBD分子处于“向上”位置。N501Y突变毒株的S蛋白则表现为单一构象:两个RBD分子处于“向上”位置。每个RBD分子都会绑定到VH-Fc ab8上,突变的存在不会改变RBD与中和抗体的相互作用,不存在免疫逃逸现象。
B.1.1.7突变毒株表现为与ACE2亲和力增强、病毒传染能力增强,但是研究发现mRNA新冠疫苗BNT162b2接种者血清对于B.1.1.7毒株S蛋白中和活性影响不大,推测B.1.1.7突变毒株不会影响现有的疫苗及中和抗体研究。

B.1.351变异株出现于2020年8月,截至2020年12月底,南非由B.1.351引起的感染比例已超80%。研究人员对南非190个样本序列进行分析,结果显示与南非第一波流行的主要谱系B.1.1.54、B.1.1.56以及C.1相比,B.1.351整个基因组和棘突区域的核苷酸替换和氨基酸变化数量最多,呈现明显的超突变。
B.1.351在棘突蛋白(S)上有10个突变点分别是:
a)位于S1 N末端结构域(NTD)的L18F、D80A、D215G、L242_244del(或L242H)、R246I;
b)位于受体结合域(RBD)上的K417N、E484K、N501Y;
c)位于S1 C末端结构域的D614G;
d)位于S2上的A701V。
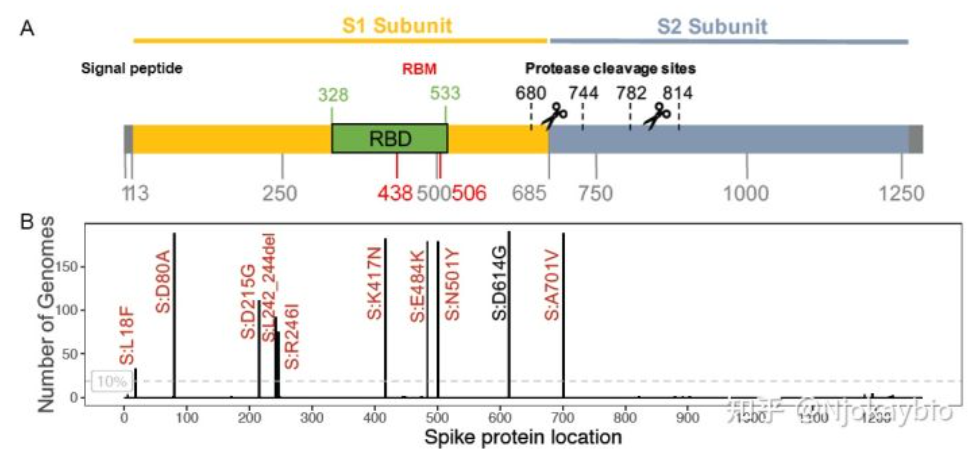
B.1.351基因组棘突区的氨基酸变化对应的蛋白序列位置
注:图中黑线长度表示含有特定突变的基因组的数量
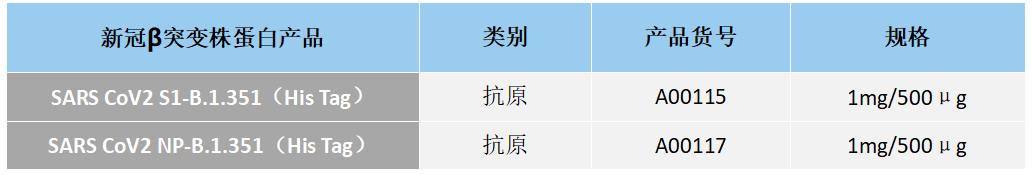
数据显示RBD是SARS-CoV-2免疫血清中90%的中和活性靶点。RBD的突变可能会影响中和抗体(NAbs)的中和效率。N501Y、E484K及K417N的突变会对两类NAbs的中和作用有影响。第一类NAbs由VH3-53基因片段编码,其中心是棘突残基K417,可阻断hACE2,仅与“up”RBD结合,可交联单个三聚体内的相邻RBD。第二类NAbs与穗状残基E484结合,可阻断hACE2,与”up”和“down” RBD结合,并与相邻RBD接触。K417N/N501Y突变将消除与第一类NAbs的关键作用,可能导致该位点的免疫逃逸。E484是一个显性中和表位,E484K突变可以使SARS-CoV-2有效避开第二类中和抗体,E484K突变已被证明对该类NAbs和恢复期血清产生耐药性。(江苏东抗RBD E484K蛋白原料,Cat.No.A00114)

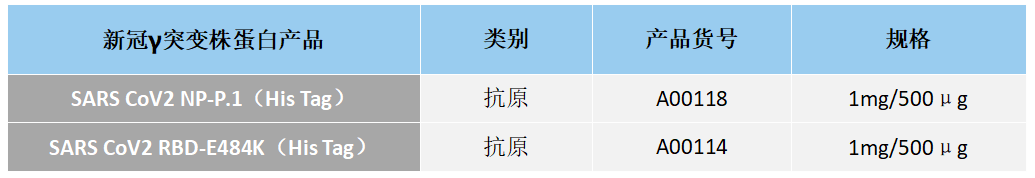
2021年1月,日本发现,4名从巴西入境日本国的旅客感染了一种变异新冠病毒,且与英国和南非发现的变异新冠病毒不完全相同。巴西和英国研究人员推测,这4人感染的可能是P.1变异新冠病毒。2021年1月14日,据巴西媒体报道,巴西和英国研究人员在分析采集自巴西亚马孙州的新冠病毒样本时,发现了一种名为P.1的新型变异新冠病毒。2020年12月15日至23日在亚马孙州首府玛瑙斯市采集的31份新冠病毒阳性样本中,有13份检测出变异新冠病毒P.1。
Gamma株的Spike蛋白有10个突变 (L18F、T20N、P26S、D138Y、R190S、H655Y、T1027IV1176、K417T、E484K和N501Y),有三个突变(L18F、K417T、E484K)位于RBD区域,与Beta株相似。重要的是,这种变体可能降低单克隆抗体治疗、恢复期血清和接种后血清的中和作用。
参考文献:
[1] Yurkovetskiy L , Wang X , Pascal K E , et al. Structuraland Functional Analysis of the D614G SARS-CoV-2 Spike Protein Variant[J]. SSRNElectronic Journal, 2020.
[2] The New SARS-CoV-2 Strain Shows a Stronger BindingAffinity to ACE2 Due to N501Y Mutation.
[3] Molecular Mechanism of the N501Y Mutation for EnhancedBinding between SARS-CoV-2's Spike Protein and Human ACE2 Receptor.
[4] Cryo-EM Structure of the N501Y SARS-CoV-2 Spike Proteinin Complex with a Potent Neutralizing Antibody.
[5] Jun Lan, Jiwan Ge, Jinfang et al. Structure of theSARS-CoV-2 spikereceptor-binding domain bound to the ACE2receptor [J]. Nature,2020
[6] Starr TN, Greaney AJ, Hilton SK, et al. Deep MutationalScanning of SARS-CoV-2Receptor Binding Domain Reveals Constraints on Foldingand ACE2 Binding[J]. Cell, 2020
[7] Wang Y, Liu M, Gao J. Enhanced receptor binding ofSARS-CoV-2 through networks of hydrogen-bonding and hydrophobic interactions[J]. Proc Natl Acad Sci USA,2020
[8] H Tegally,E Wilkinson,M Giovanetti, et al. Emergence and rapid spread of a new severeacute respiratory syndrome-relatedcoronavirus 2 (SARS-CoV-2) lineage withmultiple spike mutations in South Africa[J]. medRxiv, 2020
[9] CO Barnes,CA Jette,ME Abernathy, et al.SARS-CoV-2 neutralizing antibodystructuresinform therapeutic strategies[J].Nature, 2020
[10]Constantinos Kurt Wibmer,FrancesAyres,Tandile Hermanus, et al. SARS-CoV-2 501Y.V2escapes neutralization by South African COVID-19 donor plasma [J]. BioRxiv,2021.
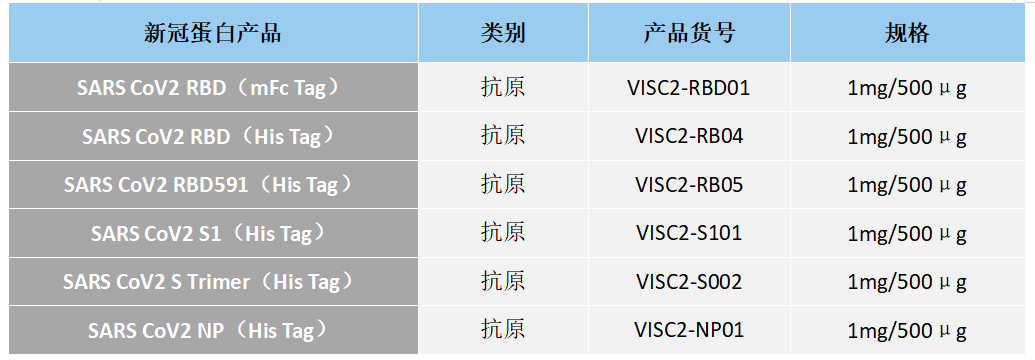
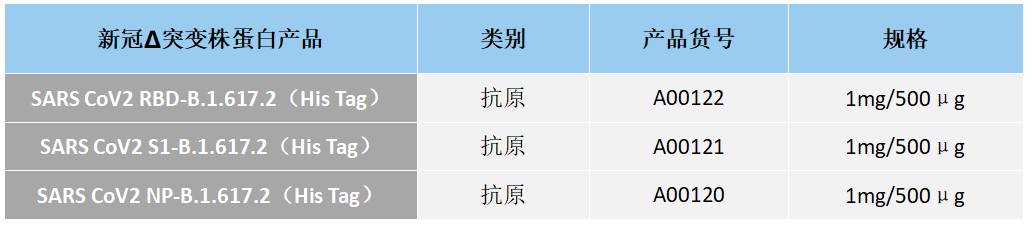
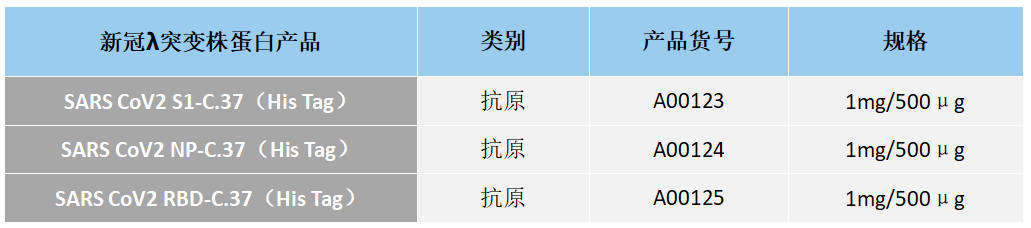
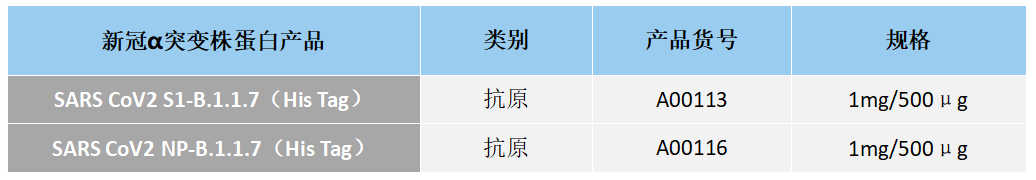
江苏东抗高品质新冠诊断蛋白产品
咨询
- 300
- 点赞
- 复制链接
- 举报