mRNA疫苗质量控制及质粒制备工艺探究
新型冠状病毒肺炎(COVID-19)在全球范围的大流行造成了严重的公共卫生危机,已成为导致死亡的主要原因之一。

新型冠状病毒肺炎(COVID-19)在全球范围的大流行造成了严重的公共卫生危机,已成为导致死亡的主要原因之一。据WHO数据显示,截至2022年6月17日,已有确诊535,248,141例,死亡6,313,229例。为减轻COVID-19对公共健康和社会经济的影响,全球疫苗研发机构均在积极开发疫苗。其中mRNA疫苗由于生产周期短、成本效益高、设计通用性高等优点而备受瞩目,且由于mRNA技术在其他诸如癌症等疾病领域的潜在应用价值,使得全球掀起mRNA的研发热潮。
疫苗的研制通常需要数年的开发和测试,以确保其有效性和安全性。然而,从研发到部署,仅用了不到一年的时间就产生了两种mRNA疫苗(Moderna、Pfizer/BioNTech)。快速的生产时间、成本效益、疫苗设计的多功能性,以及临床证明的诱导细胞和体液免疫反应的能力,使带有聚光灯的mRNA疫苗成为抗击大流行最有希望的候选疫苗。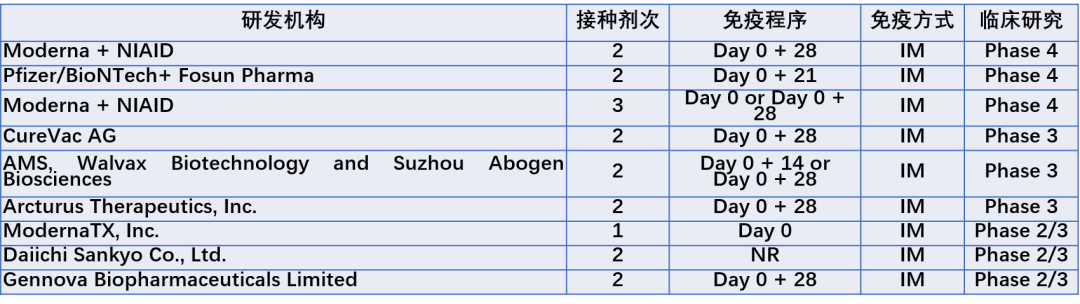
SARS-CoV-2的全球大爆发极大地推动了mRNA疫苗的研发速度,目前上市或处于三期临床的COVID-19mRNA疫苗研究进展见表1。
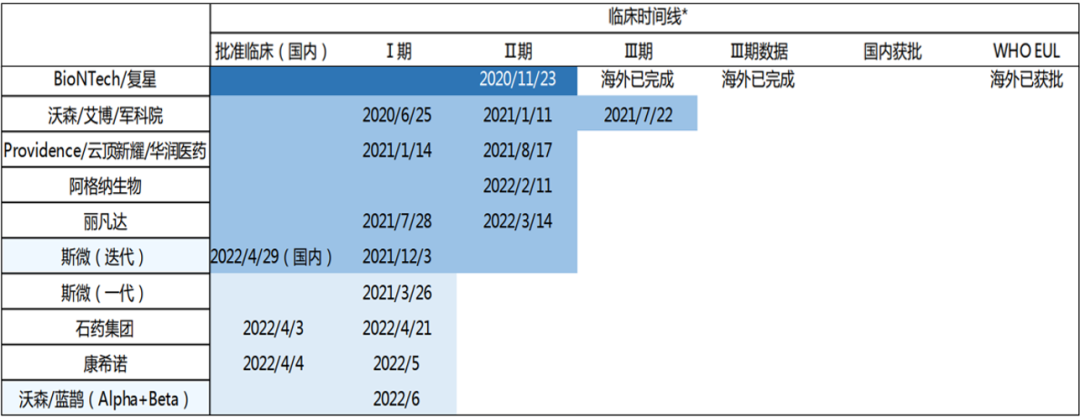
国内包括沃森生物的mRNA疫苗进入临床三期试验,进入二期临床试验国内厂家包括Providence/云顶新耀/华润医药、阿格纳生物、丽凡达3家,见表2。
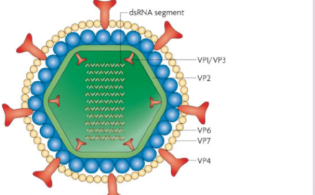
目前mRNA疫苗的生产主要是通过体外转录反应进行扩大化生产,生产制备流程见图1。类似于PCR扩增反应,mRNA体外合成以相应DNA为模板加上相应的酶和底物在适当条件下进行扩增反应。由于RNA的稳定性较弱,反应原材料的稳定性和有效性对于mRNA体外转录是至关重要。更重要的是mRNA疫苗最终作为人的治疗药物,必须保证其安全性和稳定性,使用合格合适的原材料是其安全性的第一道关卡。
随着mRNA疫苗的逐渐应用,其质量控制显得尤为重要。早在2020年08月15日,国家药监局药审中心制定并发布了《新型冠状病毒预防用mRNA疫苗药学研究技术指导原则(试行)》,为指导我国新冠疫苗的临床研发,提供可参考的技术标准。面对新冠疾病大流行的影响,快速且有效地开发疫苗药物是关键。mRNA疫苗在应对疾病预防方面发挥着越来越突出的作用。而质粒作为mRNA疫苗重要的原料药,市场需求也随之涨高,因此需要进一步提高质粒的产能。
咨询
- 298
- 点赞
- 复制链接
- 举报