文献解读 | 单细胞核RNA测序表明MBD5、MBD6和SILENZIO在发育花粉的营养细胞中沉默基因表达
转座元件(TEs)的沉默驱动了转录调控机制的演化,拟南芥MBD5、MBD6和SILENZIO是DNA甲基化下游的TE抑制因子。

期刊:Cell Report
影响因子:7.5
主要技术:单细胞核RNA测序(snRNA-seq)
导语
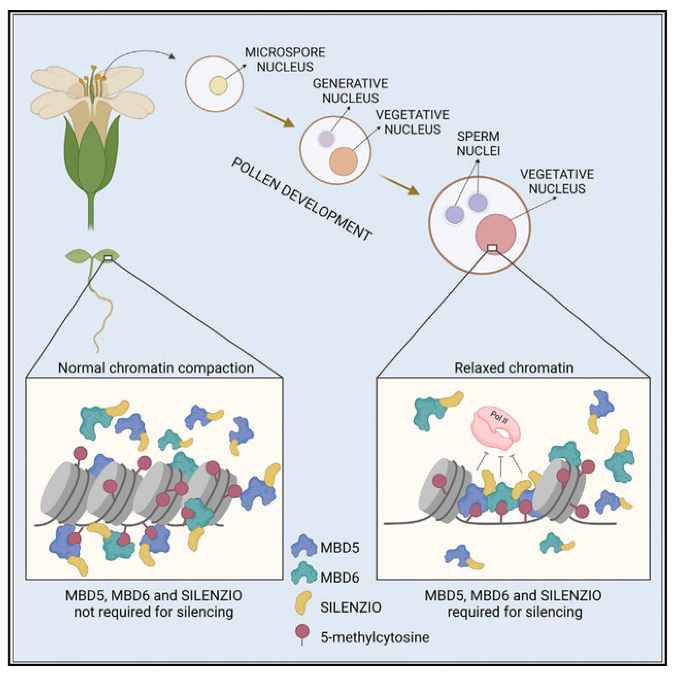
转座元件(TEs)的沉默驱动了转录调控机制的演化,拟南芥MBD5、MBD6和SILENZIO是DNA甲基化下游的TE抑制因子。本文对发育中雄配子体的单核RNA测序分析结果显示,这些抑制因子对花粉营养细胞(VN)中的TE沉默至关重要,而VN是受精过程中一种重要的辅助细胞,同时发生染色质开放。其他沉默突变体(met1,ddm1,mom1,morc)在所有花粉核类型和体细胞中表现出沉默的丧失。作者发现,被MBD5/6抑制的TE在野生型营养细胞核中获得染色质可及性,表明染色质开放状态下,它们对mbd 5/6的损失更为敏感。同样mbd 5/6 h1突变体,染色质开放性增强,mbd 5/6依赖的TE在叶中去阻遏。因此,mbd 5/6和SILENZIO作为沉默系统,在染色质致密化受损时特别重要。
技术服务
单细胞核RNA测序(snRNA-seq)
研究结果
1. 发育花粉中,mbd 5/6 TE去抑制表型最为显著
花序组织中,mbd 5/6和sln突变体植物显示出少量TE和受DNA甲基化调控的基因轻度去阻遏,如基因FWA。为探究沉默丧失是否仅发生在花内的特定细胞类型中,作者将未开放的花蕾中含有发育中花粉粒的花粉囊与花蕾的其余部分(包括心皮、花瓣和萼片)分离(简称“无花粉囊”)(图1A),进行RNA-seq测序以比较野生型、mbd 5/6和sln突变型中的基因表达谱。结果显示mbd 5/6和sln突变体中的FWA去阻遏仅发生在花药中(图1B)。作者构建了转录报告细胞系,通过GUS指示FWA的表达,结合DAPI染色,确定了在花药组织内,FWA仅在雄配子体中从花粉发育的早期阶段被重新激活,并且其表达在成熟花粉中降低。
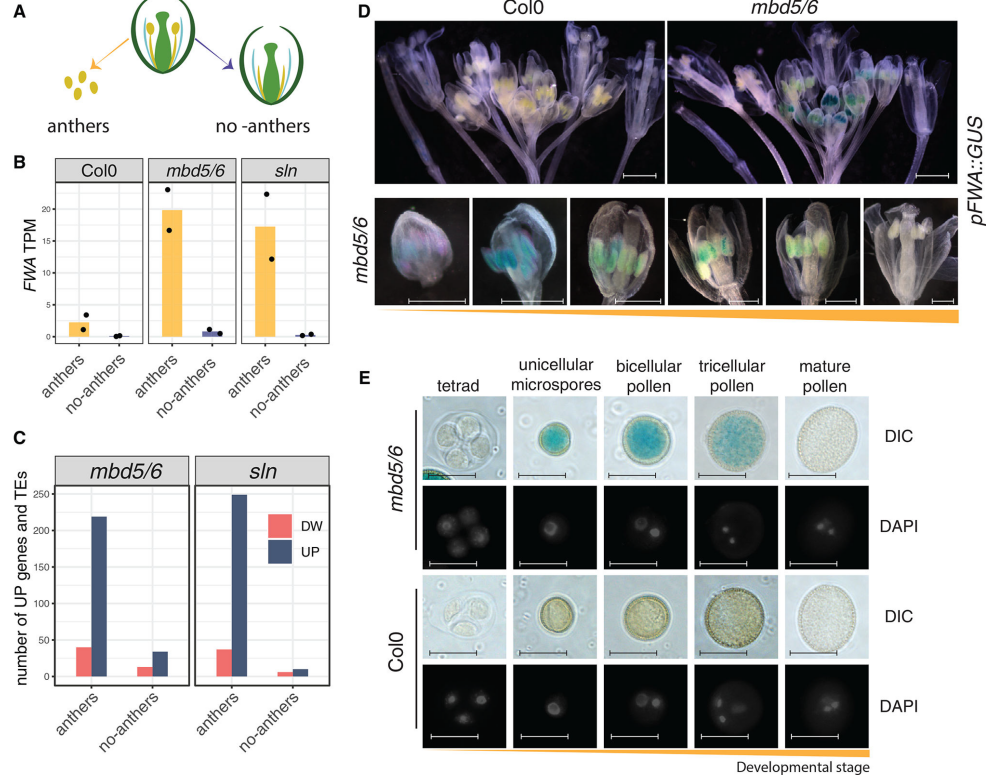
图1 mbd 5/6中FWA去阻遏仅限于发育中的花粉粒
作者进一步研究和比较了幼苗、未开放花蕾和成熟花粉中的基因表达模式。发现成熟花粉中的上调差异基因数明显高于幼苗和花蕾(图2A)。统计不同组织中差异倍数的分布,发现花粉up-DEG在花蕾中也多上调表达,只是上调幅度较低(图2B),在幼苗中不上调(图2B)。而甲基化突变体metl中观察到,约一半的花粉DEG在幼苗中也上调(图2B),作者猜测一部分mbd 5/6花粉DEG在幼苗中被DNA甲基化抑制,且mbd 5/6损失不足以重新激活它们。
2. mbd 5/6突变体中,花粉中上调的转录本多是被CG甲基化抑制的基因或TE
分析花粉RNA-seq数据集,该数据集包括mbd 5和mbd 6单突变体,三种不同的mbd 5/6双突变体等多种突变体,分析结果显示mbd 5/6靶标大多是异染色质基因座,且主要是由CG甲基化抑制。MBD5和MBD6广泛调节被CG甲基化抑制的TE家族。作者还鉴定了一些与FWA相似的功能基因,具有启动子甲基化并被mbd 5/6和MET 1抑制。在研究的组织中,mbd 5/6和sln的转录表型在花粉中最强,并且MBD5/6靶标是被CG甲基化抑制的基因和TE。
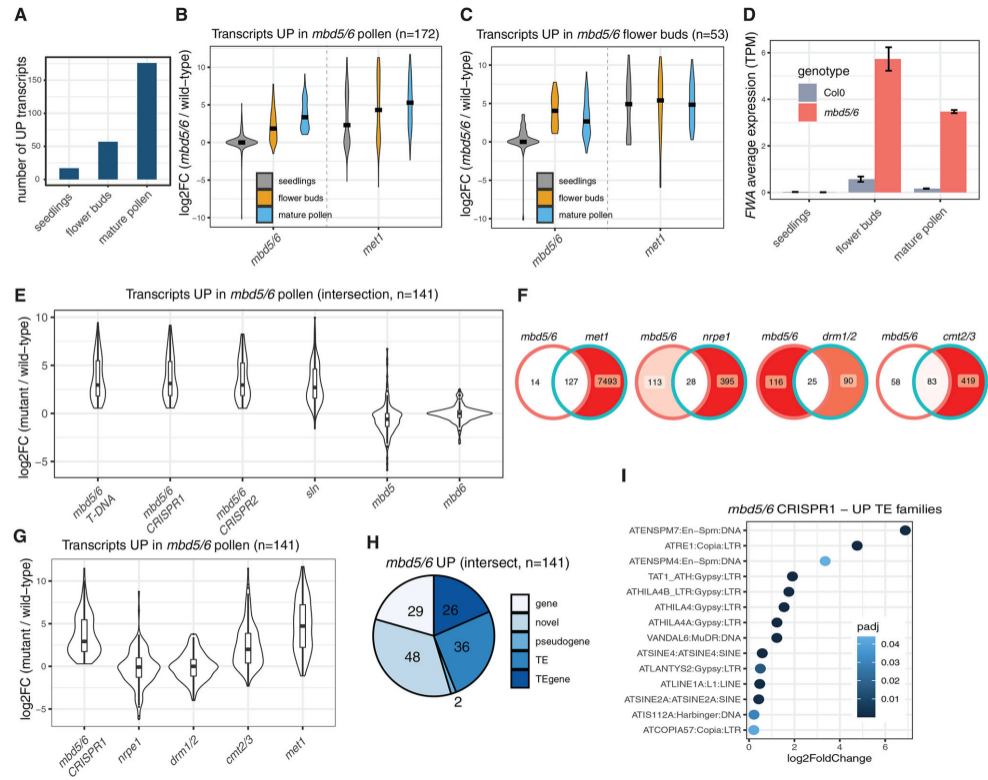
图2 mbd 5/6转录去阻遏表型的组织特异性
3. snRNA-seq揭示了发育中的雄配子体细胞核的转录景观
因花粉粒含有不同的细胞核类型,作者使用snRNA-seq来确定在花粉发育过程中哪些特定的细胞核发生了转录变化。单细胞结果中,作者鉴定到了小孢子核(MN)、精子核(SN)、营养核(VN)、生殖核(GN)、和一些污染核(图3C、D)。UMAP中,可以清晰看到VN的发育轨迹:从双细胞阶段到三细胞和成熟花粉(标记为VN1至VN5)(图3C)。此外作者还鉴定了GN1、GN2、MN1、MN2和MN3,并详细分析了各个簇中的基因表达模式,如DNA甲基转移酶、小RNA机制的表达模式、组蛋白变体等。总的来说,该snRNA-seq数据集提供了拟南芥雄配子体发育过程中整体基因表达谱,是相关研究的重要基础。
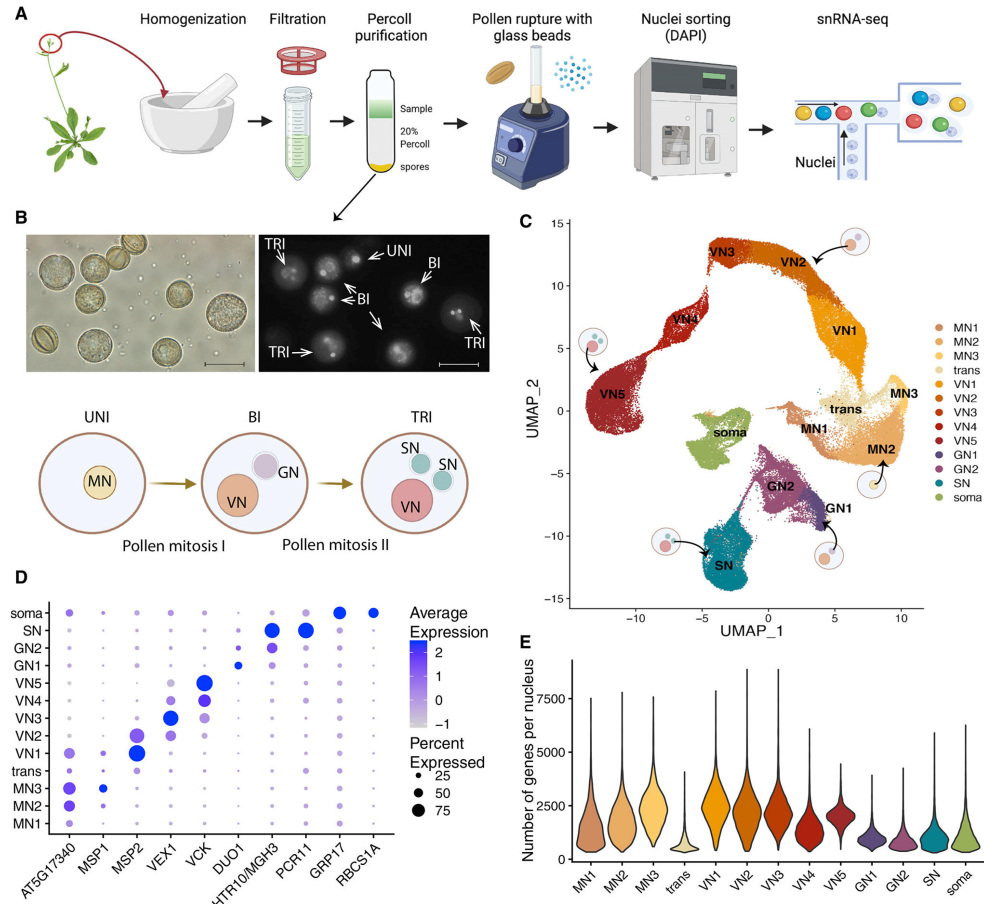
图3 发育中的雄配子体的snRNA测序
4. MBD5/6靶标在VN谱系中去阻遏
为研究花粉发育期间mbd 5/6去阻遏的细胞类型特异性,作者对ColO、mbd 5/6和sln突变体进行snRNA-seq(图4A)。发现mbd 5/6中,FWA基因在小孢子晚期表达增加,在双细胞花粉的VN中达到峰值,在VN的双细胞晚期开始降低(图4B)。作者将mbd 5/6与每个簇的野生型进行差异比较,发现大多数DEG在早期或晚期VN簇中上调(图4C),这些基因的特征是启动子甲基化,其中包括几个TE和新的注释(图4C和4E)。进一步分析VN发育轨迹,发现这些DEG中,54个基因在早期VN中表达,然后沉默。83个DEG基因在晚期VN中上调(图4F)。有趣的是,在野生型中也观察到了同样的模式,但幅度要低得多。表明去阻遏的阶段特异性可能反映了所需发育阶段特异性转录因子的表达。总的来说,snRNA-seq数据揭示mbd 5/6和sln中沉默的丧失开始于小孢子晚期,并且在VN中沿着其发育轨迹逐渐变得更加突出,而GN和SN不受影响。
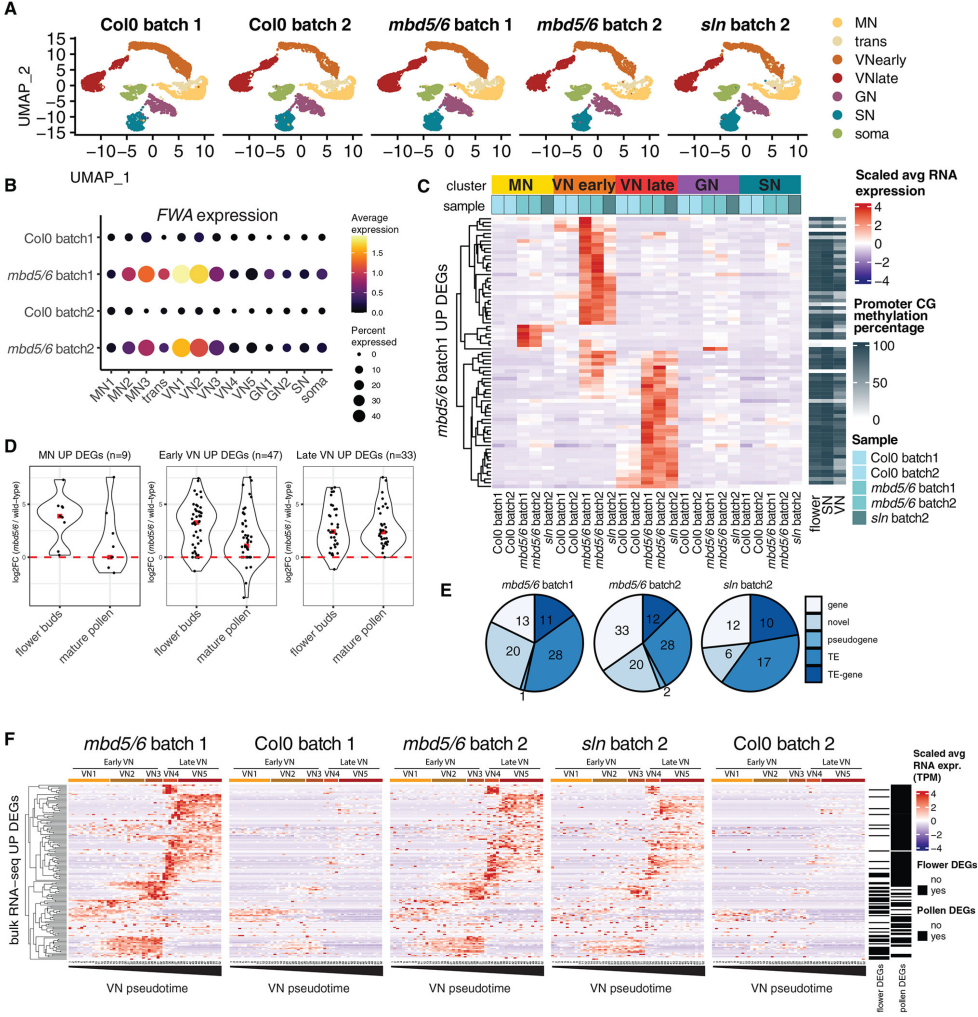
图4 mbd 5/6中的转录去抑制仅限于MN/VN谱系
5. 其他沉默突变体在所有花粉核类型中都表现出广泛的去阻遏作用
为探究参与甲基化DNA沉默的其他基因中的突变是否可能显示出与mbd 5/6相似的模式,作者用一组具有TE去阻遏的突变体及对应的野生型进行了雄性配子体snRNA-se,并注释到了对应于花粉发育的最成熟阶段(VN4、VN5、SN)的相对较少的细胞,这可能是由于metl植物中花发育的表型缺陷(图5A)。
差异分析结果显示,在met1、ddm1、mom1、morc等突变体,与mbd5/6和sln的DEG明显不同,且各突变株的不同细胞类型中上调表达的基因也有不同。比较不同突变体的上调DEG发现,虽然大部分mbd 5/6靶标在metl和ddm1中上调,但它们在mom1或morc中没有上调(图5F)。同样,mom1和morc靶标主要是met1和ddm1靶标的子集,并且它们彼此很大程度上重叠,但在mbd 5/6中没有上调(图5F)。因此,作者猜测MBD5/6靶标构成了由DNA甲基化调控的基因座的独特子集。
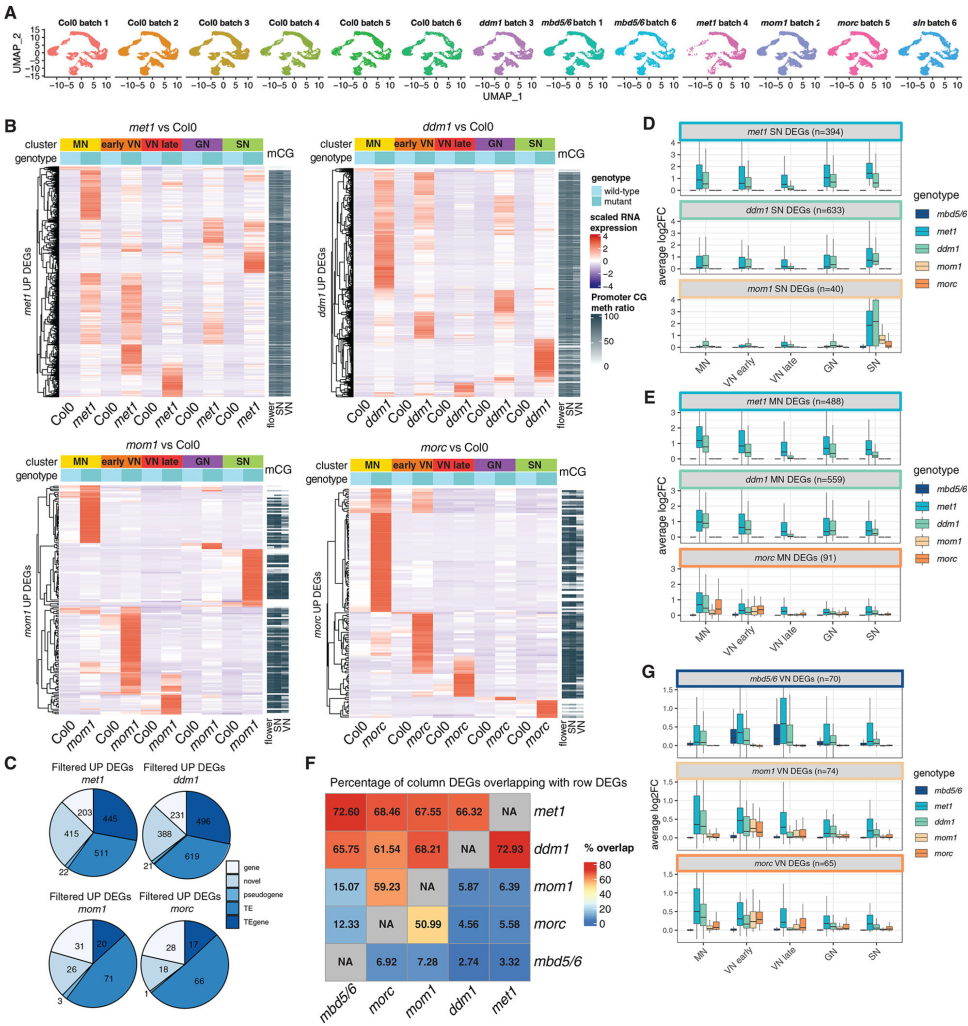
图5 met1、ddm1、mom1和morc突变体在所有花粉细胞中表现出沉默缺失
6. 组蛋白H1的缺失揭示了mbd 5/6和sln在非生殖组织中的去阻遏表型
为探究VN细胞中的松弛染色质状态是否与mbd 5/6中沉默丧失的VN特异性有关,作者分析了包括从野生型GN、SN和成熟VN分离的细胞核进行的转座酶可及染色质测序结果。作者观察到,在野生型VN中,mbd 5/6靶标处染色质可及性明显增加,并且在VN中失去更多的CG甲基化,这可能是因为启动子的开放性促进DME的接近(图6B)。然而,虽然VN中特定花粉育性基因的DME介导的去甲基化是非常广泛的,导致这些基因高度表达并且不受mbd 5/6调节,但是mbd 5/6靶标处的甲基化损失较温和,并且仅导致野生型VN中非常低的表达水平(图6B-E)。
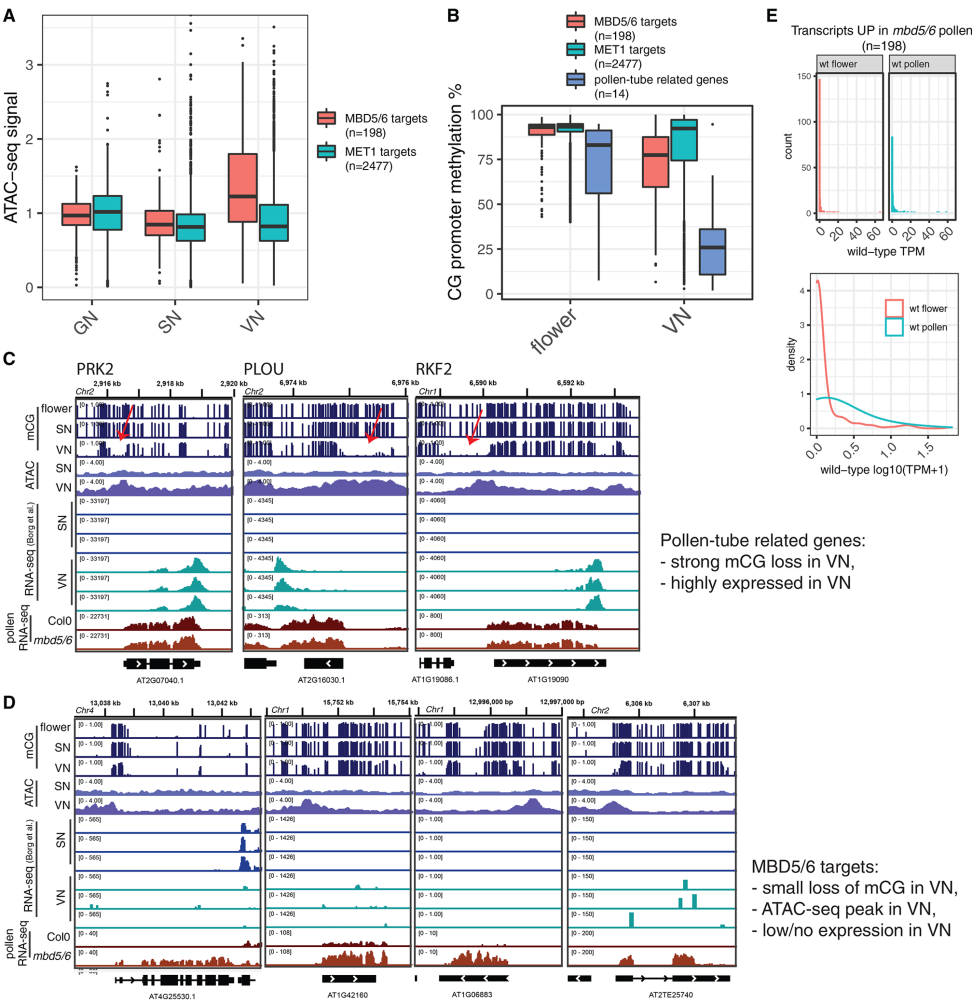
图6 mbd 5/6靶点的特征是野生型VN中的可及性增加
作者猜测,在mbd 5/6和sln幼苗中没有可检测到的TE去阻遏的原因可能是染色质高度压缩补偿了甲基阅读器的损失,并且足以维持基因沉默。为了验证这个想法,作者将mbd5/6和sln与h1.1/h1.2双突变体(简称h1,幼苗染色质去致密化)杂交。RNA-seq结果显示,mbd5/6或sln幼苗中不表达的FWA基因在h1中低表达,而在mbd5/6 h1和sln h1中明显增强。此外,约有50个基因在mbd5/6和sln中表现出上调,而在mbd5/6 h1或sln h1中上调更加显著。表明mbd 5/6和sln在更广泛的组织中具有基因沉默功能,但其他沉默途径阻止了VN以外的大多数细胞中靶基因的上调。
图7 H1突变增强了幼苗中mbd 5/6的去阻遏表型
参考文献:
[1] Ichino L, Picard CL, Yun J, et al (2022) Single-nucleus RNA-seq reveals that MBD5, MBD6, and SILENZIO maintain silencing in the vegetative cell of developing pollen. Cell Rep 41:111699. https://doi.org/10.1016/j.celrep.2022.111699
咨询
- 176
- 点赞
- 复制链接
- 举报