原代肝细胞分离试剂盒
- LV-PHIK001-5T
- 立沃
- 广东省深圳市
- 一周内
- 5T
- 3500元
- 2022-05-31 18:16:56
立沃生物科技(深圳)有限公司
标准操作流程
(以 C57/ICR 小鼠为例)
一、设备和试剂准备
(一)仪器设备
超净工作台或者生物安全柜、水浴锅、蠕动泵(LongerPump,YZ1515X)、手推式电动废液缸、一次性 100mm 培养皿 1 个、乳胶管(灭菌、长度 168cm, 规格充满 14ml 液体)、灭菌剪刀和镊子若干、灭菌动脉夹、灭菌止血钳、一次性输液针(黑色 0.7*25)、电动移液器、一次性 15/50mL 离心管若干、一次性 50mL注射器及 0.22μm 过滤器若干、100mL 无菌试剂瓶、离心机、泡沫板、废液托盘、固定针头、一次性 5ml 巴氏吸管、75%酒精及其喷壶、0.4%台盼蓝及血球计数板、碎冰、泡沫盒、新鲜配置 6%的戊巴比妥钠。
(二)试剂盒试剂耗材
表 1 试剂盒清单
|
名称 |
货号 |
规格 |
数量 |
|
灌注溶液A |
LV-PHIK00101 |
500mL/瓶 |
1 瓶 |
|
灌注溶液B |
LV-PHIK00102 |
500mL/瓶 |
1 瓶 |
|
细胞洗液 |
LV-PHIK00103 |
500mL/瓶 |
1 瓶 |
|
活细胞纯化液 |
LV-PHIK00104 |
30mL/瓶 |
1 瓶 |
|
0.22µm 过滤器 |
LV-PHIK00105 |
5 个/包 |
1 包 |
|
20mL 注射器 |
LV-PHIK00106 |
5 支/包 |
1 包 |
|
70µm 细胞筛 |
LV-PHIK00107 |
5 个/包 |
1 包 |
|
精选胶原酶 |
LV-PHIK00108 |
5 支/盒 |
1 盒 |
|
EGTA 母液 (100x) |
LV-PHIK00109 |
1.1mL/支 |
5 支 |
|
抗生素 |
LV-PHIK00110 |
16mL/瓶 |
1 瓶 |
(三)试剂准备
1)灌注溶液 A(LV-PHIK00101)工作液:无菌条件下,取 100mL 灌注溶液 A 至 100mL 无菌试剂瓶,补加 1mL EGTA 母液(LV-PHIK00109)、1mL 抗生素(LV-PHIK00110)。注意:理论上 70mL 灌注溶液 A 工作液足够灌注一只小鼠,在熟练的情况下可进一步优化。
2)灌注溶液 B(LV-PHIK00102)工作液:无菌条件下,取 100mL 灌注溶液 B,取一支精选胶原酶(LV-PHIK00108),利用约 20mL 灌注溶液 B 充分溶解精选胶原酶,0.22µm 过滤器(LV-PHIK00105)过滤,最后补加 1mL 抗生素(LV-PHIK00110)。注意:理论上 70mL 灌注溶液 B 工作液足够消化一只小鼠,在熟练的情况下可进一步优化。
二、试验装置试运行
(一)设备、耗材、试剂等放在合适的位置;将灌注溶液 A 工作液、灌注溶液 B 工作液放入水浴锅,水浴锅温度调至 37℃,预热 60 分钟(需计时),使酶活性更加稳定;细胞洗液放入 4℃冰箱预冷 30-60 分钟;将设备按照以下布局进行管道连接,打开细胞房、工作台的洁净风,紫外照射 15 分钟。
(二)此步骤在上述预热过程中完成:动物称体重,将动物用 6%的戊巴比妥钠 80mg/kg 进行麻醉(麻醉时间约 2 小时内有效),麻醉后用酒精喷全身进行消毒,在泡沫板上(废液托盘上)用固定针固定好四肢。
(三)准备一次性 100mm 皿,加入 10mL 灌注溶液 B 工作液,常温放置于灌注装置附近;将细胞洗液和 50mL 离心管插入碎冰中预冷。
(四)将乳胶管插入灌注溶液 A 工作液中,打开蠕动泵,确定蠕动泵运行方向,测试管道是否运行平稳,确认管道内无气泡;
(五)小鼠灌注速度为 7-9 mL/min(根据动物大小适当调整),根据经验设置蠕动泵转速,通过单位时间内收集的液体体积测定流速;记录目标转速后,将转速调至 1r/min,待用。
三、实验步骤
(一)用镊子夹起小鼠腹部表层皮肤,并从中间剪一小口后向两侧剪开直至暴露整个内层皮肤,将皮剪除;
(二)换新的无菌剪子与镊子,夹起腹部内层皮肤从中间剪一小口后向两侧剪开直至暴露整个腹腔,用固定针固定两侧皮肤以及内层皮肤,防止皮毛污染肝脏细胞;
(三)用镊子轻轻将胃及肠子往右翻开,暴露下腔静脉,打开蠕动泵(此时流速是 1r/min),将注射针(链接灌注液,整个灌注装置已排除空气)插入下腔静脉,开始灌注,见肝脏有变白则立即剪断肝门静脉;将灌流速度缓慢加大到7-9mL/min,流速可以 1-2ml/秒的速度递增(建议让助手调节流速);并剪破心脏,用止血钳或者动脉夹夹住上腔静脉,此时夹住肝门静脉可见肝脏较易膨大并立起来,说明插入位置正确灌注成功。
(四)小鼠灌注溶液 A 工作液 70ml,约 6-8min;灌注溶液 B 工作液 70ml, 约 6-8min。灌注溶液 B 工作液的灌注过程中,需将肝门静脉夹住 5 次,每次约2-5 秒,使肝脏膨胀,肝内增加的压力有助于肝脏的消化,从而提高产率。
(五)灌注消化液直至肝脏失去弹性,用镊子按压肝脏,肝脏会形成明显压印,说明消化完成。
(六)将肝脏快速(1-2min 内)从动物身上解离下来,转移到盛有 10mL 灌注溶液 B 工作液的培养皿中,将组织扯破,小心将细胞抖落;如消化充分,可及时加入足量细胞洗液。(此时所有涉及肝细胞处理的步骤必须使用无菌器材并且动作要轻柔,此时的肝细胞非常脆弱,并且易受剪切力的损伤)。加入足量预冷细胞洗液(总的细胞洗液体积为 30ml),细胞悬液过 70μm 细胞筛(提前底部
预湿)。
(七)50g,4℃,5min 离心。预冷细胞洗液(约 30ml/1-2 只小鼠肝细胞) 重悬细胞,轻轻吹散细胞,50g,4℃,5min 离心,重复 2 次。
(八)预冷细胞洗液重悬细胞(约 30ml/1-2 只小鼠肝细胞),台酚蓝(台酚蓝:细胞=1:9)计数。
一般而言 8-12 周龄的 C57 小鼠,每只可分离出的原代肝细胞总产量在3-5×107 个,平均产量应该约为4×10^7,产量低于3×10^7/鼠表明操作过程出错。活的、健康的肝细胞具有明亮、清澈、平滑、小而圆的外观。受损、死亡的细 胞通常呈蓝色、肿胀、粗糙、呈颗粒状(此标准对其它物种肝细胞也是一样的)。
(九)细胞纯化:如果活力过低(低于 80%),需要进行纯化处理。
1、50g,4℃离心 5 分钟,去上清;如纯化 1 只小鼠的肝细胞,在 50mL 离心管中利用 10mL 活细胞纯化液(LV-PHIK00104)重悬细胞,然后沿管壁向离心管小心地加入 5ml 细胞洗液(LV-PHIK00103)(切勿扰动下层,加入后可见明显分层)。
2、800×g,4℃离心 20 分钟,降速加速度设置为 1;离心后,吸取活细胞纯化液(LV-PHIK00104)和细胞洗液(LV-PHIK00103)之间浑浊带(活细胞层),转移到新的 50mL 离心管中,加入 2 倍体积的细胞洗液(LV-PHIK00103),上下轻轻颠倒混匀,50×g,4℃离心 5 分钟。
3、去掉上清并用小鼠铺板培养基(推荐 LV-WEP006)重悬细胞,细胞计数, 确定纯化效果。理论上细胞活力可达 85%以上。
四、细胞培养
活细胞数 1×10^5/cm2(活力>80%),胶原包被培养板中小鼠铺板培养基培养 1 -2小时后,轻轻换液 1 次,将死细胞去掉,提升细胞状态;过夜培养后换成小鼠维持培养基(推荐 LV-WEM006)。
五、其它物种肝细胞的分离方案
表 2 其它物种肝细胞分离优化体系
|
物种 |
大鼠 |
兔子 |
猪 |
狗 |
猴子 |
|
参考体重 |
150g |
2kg |
20kg |
10kg |
6kg |
|
肝脏重量 |
10g |
100g |
1000g |
500g |
200g |
|
灌注方式 |
原位灌注 |
离体灌注 |
离体灌注 |
离体灌注 |
离体灌注 |
|
灌注液A 体积 |
300mL |
Va |
Va |
Va |
Va |
|
灌注时间 |
15min |
20min |
20min |
20min |
20min |
|
灌注液B 体积 |
250mL |
Va |
Va |
Va |
Va |
|
灌注时间 |
12min |
15min |
15min |
15min |
15min |
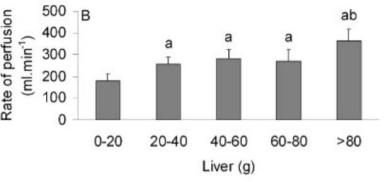
a 根据下图质量与流速的关系确定灌注体积。