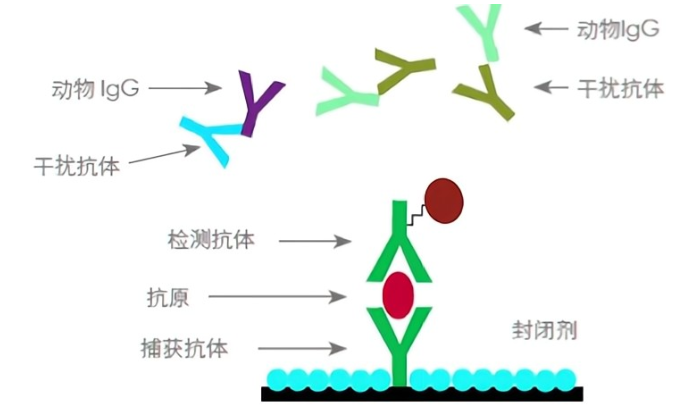
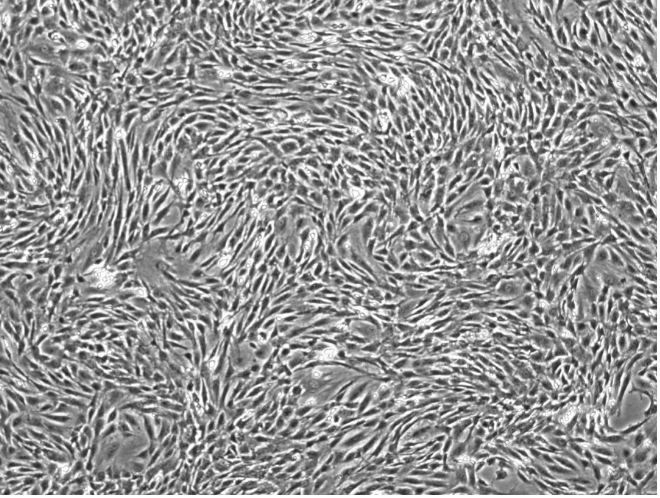
大鼠骨髓间充质干细胞的分离及培养
骨髓间充质干细胞(Bone Mesenchymal Stem Cells, BMSCs)是骨髓内除造血干细胞之外的另一类非常 重要的成体间充质干细胞,是骨髓造血微环境的重要组成部分,具有支持和调控造血的作用,能被诱导分化为成骨细胞、软骨细胞、心肌细胞等多种细胞类型
大鼠骨髓间充质干细胞的分离及培养技术
一、实验前准备
实验开始前,将眼科剪刀、眼科镊子、培养皿,15ml 离心管、移液管、移液枪、枪头等放入无菌超净工作台,以紫外线照射 30min。
1. 选取 SPF 级,体重 100~150g 左右的SD 大鼠,断颈处死。将大鼠置于体积分数为 75%的乙醇中浸泡 5 min。
2. 工作台紫外消毒后,采用通风机通风 3min。以 75%酒精擦拭操作台和双手。
3. 无菌条件下,准备好大剪刀、止血钳、眼科剪刀、眼科镊子、干净培养皿。将大鼠仰卧在超净台内的干净培养皿上。
二、全骨髓提取
1. 眼科镊沿腹股沟处提拉大鼠皮肤,眼科剪刀剪开腹股沟皮肤,暴露腿部肌肉,从关节处将大鼠大腿剪下。除去骨表面附着的软组织,置于另一无菌培养皿中。
2. 假如在平时操作中,剪刀不易将骨表面肌肉组织剔除干净,可采用无菌纱布擦拭,可方便的将肌肉组织剔除干净,提高所分离细胞的纯度。
3. 用无菌PBS 浸泡清洗。眼科剪剪断两端骨骺,显露骨髓腔,放置于 10ml 含体积分数为10%胎牛血清的新鲜DMEM 完全培养液的无菌培养皿中,取出 1mL 注射器,用镊子钳起骨头的一端,并用注射器吸取完全培养液冲洗骨髓腔至另一培养皿中,由一段骨髓腔冲出骨髓, 重复 3 次,再反方向冲出骨髓,重复 3 次。直至骨髓腔冲洗液变清亮后停止。
三、细胞制备
吹打细胞悬液,以便分散细胞,收集骨髓悬液于 15 mL 离心管中,1000 r/min 室温离心5 min。
四、接种培养
1. 离心后去上清,用 6mL 完全培养液重悬,轻轻吹打,制成单细胞悬液,转移至 25 cm
2. 培养瓶中,轻轻摇匀;置于 37 ℃、体积分数为 5%的 CO2 饱和湿度培养箱中培养。
3. 24 小时后,镜下观察,可见细胞浓度极大,全为球形的大鼠骨髓中的血红细胞,如堆积的沙粒状,悬浮于培养液中并有少量血红细胞相互聚集发生。换液,去除漂浮的血细胞, 以后每两三天换液 1 次,直到增殖达到融合。4. 约 7 天后,倒置显微镜下观察细胞形态与生长情况,可见贴壁细胞数量明显增加,融合达 80%~90%,可进行细胞传代。
五、细胞传代
待细胞融合至 80%~90%开始传代,吸去培养液,以预热的 PBS 轻轻冲洗后,吸去 PBS。采用消化液消化 1-2 分钟,骨髓干细胞贴壁特性强,比较难于消化,消化液可采用提高EDTA 浓度的方法,镜下可见细胞皱缩变圆,终止消化。本实验的消化液配方可以很好地消化,并不会损伤细胞。除消化液特殊外,其他方法同本光盘内的细胞传代方法。
本实验以 1:2 进行传代。
六、细胞观察
细胞传代到第 3 代时,生长融合后,细胞形态均一,呈长梭形集落样分布,并可重叠生长,细胞纯度可达 95%以上。此时细胞可用于后续实验,或采用表表面标志物进一步验证其纯度:验证标准为CD34 阴性,CD44 阳性。
从本实验结果中可见:全骨髓培养法可分离培养出纯度高、活力旺盛的骨髓间充质干细胞。
七、注意事项
1. 缓慢冲洗骨髓腔:
冲洗骨髓腔时为了避免冲起许多气泡损伤细胞,应缓慢冲洗。
2. 严格无菌:
取骨髓间充质干细胞的整个过程都需要谨慎,保证无菌操作
3. 培养基中血清浓度:
过多的血清中细胞因子可以促进细胞增殖,但细胞老化也快。而且一般来说,选择质量好 10%的胎牛血清有利于 MSCs 的培养
4. 原代细胞静置培养:
原代细胞置于培养箱 24~48h 内,应处于静置状态,不宜取出培养瓶观察生长状况,这将使原代分离细胞难以贴壁
咨询
- 402
- 点赞
- 复制链接
- 举报