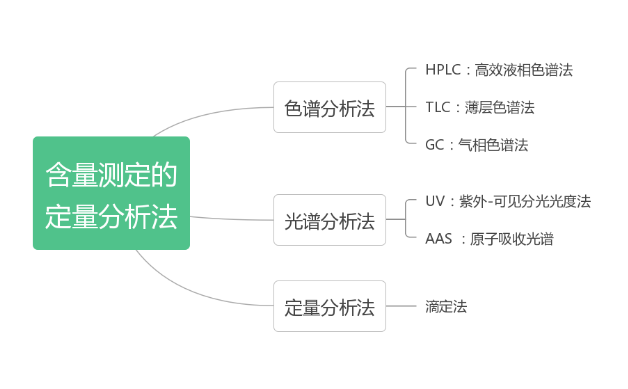
细胞转染实验技术——功能实验的第一步
转染(transfection)是真核细胞主动或被动导入外源核酸片段(DNA或RNA)而获得新的表型的过程。转染后的细胞会产生重组蛋白,或者特异性的增强/抑制细胞中的基因表达。转染后的检测主要包括基因水平和蛋白水平的检测。一定时间后收集转染处理后的细胞,采用超声或酶解的方法破碎细胞,离心得到上清。针对基因水平,使用普通 PCR 或 RT-PCR 进行验证,蛋白水平,使用 western blot 检测,简单,快速,准确。
转染的类型
根据导入的核酸存在于宿主细胞的时间长短,可以分为瞬转和稳转。根据转染方式可以分为化学方法,生物方法,物理方法。
瞬时转染是指将构建好的质粒或者siRNA通过某种方式导入到哺乳动物细胞内(常用的工具细胞 HEK293 细胞),该外源核酸片段不整合到细胞自身的基因组上。随着细胞的生长分裂,外源基因会逐渐丢失,在细胞内能够存在 3-4 天,无法随着细胞的分裂进入到子代细胞中。在这一段时间内,外源基因在细胞内发生转录翻译,得到少量的蛋白。根据使用的载体不同,收集目的基因/蛋白进行检测的时间不同,通常在转染后48h,目的蛋白的表达水平最高。瞬时转染的特点是短时间内进行蛋白的小量制备,满足后续的实验要求。
稳定转染是外源DNA整合到细胞基因组中,成为细胞基因组的一部分从而得以复制,随着细胞分裂,子代细胞也同样表达外源基因,这就是稳定转染细胞的标志。稳定转染是建立在瞬时转染的基础上的,先对细胞进行转染,再对得到的细胞池进行筛选,筛选标记是抗生素,荧光报告基团等,通常需要2-3周的筛选时间,由此形成稳定转染的细胞系。稳定转染的特点是能够得到蛋白的大量、长期生产,满足后续的一系列体内体外的表型实验。
转染方式
考虑到转染效率是影响细胞实验的重要因素,因此选择合适的转染试剂和转染方式很关键。下面我们介绍一下常见的转染方式。
细胞由带负电荷的磷脂双分子层构成,对于也带负电荷的核酸片段(DNA和RNA)来说是不可透过的屏障,因此研究人员开发了很多方法能使核酸穿透细胞膜进入胞内,大致分为三类:
|
转染方法 |
原理 |
优点 |
缺点 |
|
化学转染方法 |
|||
|
阳离子脂质体 |
脂质体是一种人工的脂双层膜。阳离子脂质体通常由阳离子和两性离子脂质组成。在DNA与脂质体形成lipoplex的过程中,阳离子脂质体起到复合和凝集DNA的作用,同时也有助于复合物与细胞膜的结合 |
操作简单快速; 转染效率高且重复性好; 可用于转染DNA、RNA和蛋白; 可用于瞬时转染和稳定转染 |
会受到血清的抑制,降低转染效率; 脂质体中的核心组分对细胞毒性较大 |
|
磷酸钙共沉淀 |
核酸以磷酸钙-DNA 共沉淀物的形式出现时,可使DNA 附在细胞表面,利于细胞吞入摄取,或通过细胞膜脂相收缩时裂开的空隙进入细胞内 |
便宜,使用广泛 |
转染效率差,不稳定; 细胞毒性大; |
|
葡聚糖 |
它是一种阳离子聚合物,可以与带负电荷的DNA和蛋白质结合,进而被细胞吞噬 |
多用于贴壁细胞 |
一些细胞类型对葡聚糖特别敏感,可能会发生形态变化或者抑制细胞生长 |
|
其他阳离子聚合物 |
带正电的聚合物与核酸带负电的磷酸基团形成带正电的复合物后与细胞表面带负电的蛋白多糖相互作用,并通过内吞作用进入细胞。阳离子聚合物和阳离子脂质体最大的区别在于阳离子聚合物不含疏水部分而完全溶于水,可以方便地进行化学修饰,且不会像脂质体一样破坏细胞结构,所以相对毒性较低。目前使用最广泛的阳离子聚合物转染试剂是货号:VTY24085(聚乙烯亚胺,英文名pei) |
成本低; 免疫原性低; 转染效率高且稳定; 适用于悬浮细胞或贴壁细胞
|
细胞毒性较大; 常用于瞬时转染; 不能生物降解 |
|
物理转染方法 |
|||
|
电穿孔 |
利用高脉冲电压破坏细胞膜电位,使得DNA 通过膜上形成的小孔导入稳定/瞬时性转染 |
适用所有细胞类型; 适用瞬时转染和稳定转染; 不需要载体 |
需要一定的电转设备; 需要优化电转脉冲和电压参数; 细胞致死率高; DNA和细胞用量大 |
|
显微注射 |
利用管尖极细(0.1至0.5μm)的玻璃微量注射针,将外源基因片段直接注射到原核期胚或培养的细胞中 |
适用所有细胞类型; 可进行单细胞转染; 不需要载体; 不限制转入的基因大小和数量; 多用于转基因 |
设备昂贵; 技术要求高; 细胞致死率高 |
|
生物转染方法 |
|||
|
病毒转染 |
病毒该载体可以将外源基因有效地整合到宿主染色体上,从而达到持久性表达 |
转染效率高; 适用于难转染的细胞系; 可用于体内转染 |
周期长,程序复杂; 费用相对高; 存在生物安全问题 |
转染的影响因素:
转染过程中许多因素会影响转染效率:如细胞类型;细胞密度;质粒大小、质粒纯度;血清;转染试剂等。
转染实验中,以下几个因素进行调整和优化:
1. 转染前的细胞状态和密度
转染时细胞密度以 50-80%最佳,细胞密度过高会严重影响细胞状态和转染效率(周期进程阻滞,凋亡增加等)。同时支原体污染会严重降低细胞的转染效率,因此转染前可用环丙沙星处理细胞以除去支原体。
2. 转染时的质粒纯度
如果提取的质粒不纯,如带少量盐离子,蛋白、代谢物污染等都会显著影响转染复合物的有效形成;而含有内毒素的质粒对细胞存在很大的毒性作用(一般用去内毒素的提取试剂盒)。抗生素一般对真核细胞无毒,但转染过程中细胞通透性增加,会使抗生素进入细胞,从而降低细胞活性,导致转染效率降低。
3. 转染后的筛选时间
转染后筛选不能太早或太晚,因为转染了外源基因的细胞代谢负荷大,增殖较慢,太晚会被没有外源基因转入的细胞所淹没,最终导致筛选不出阳性克隆。一般要在转染后48h之后开始加抗生素筛选。
4. DNA 与转染试剂的比例
许多转染方法需要优化 DNA 与转染试剂的比例。不同细胞系转染效率通常不同,不同转染试剂转染效率差别很大,通常需要根据转染试剂说明书进行预实验,选择合适浓度的外源DNA或RNA,调整外源核酸片段和转染试剂的比例。
相关产品推荐:
|
品牌 |
货号 |
中文名 |
|
JSENB |
JS0332 |
无菌水 |
|
JSENB |
JS0272 |
甘油 |
|
JSENB |
JS0035 |
胞嘧啶核苷 |
|
JSENB |
JS0482 |
琼脂糖 |
|
JSENB |
JS0154 |
IPTG |
咨询
- 240
- 点赞
- 复制链接
- 举报