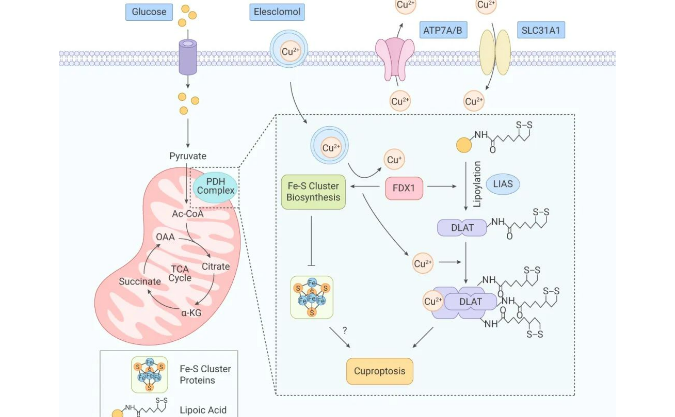
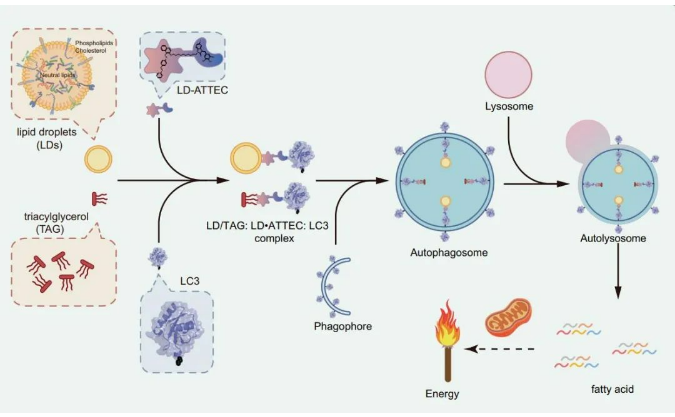
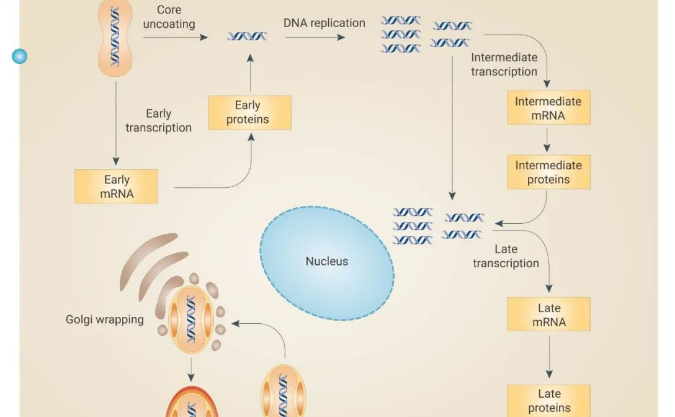
引人关注的核酸产业园 | mRNA 疫苗究竟是?
核酸是核苷酸聚合成的生物大分子化合物(可分为脱氧核糖核酸 DNA 和核糖核酸 RNA),是生命的最基本物质之一。以 DNA 或者 RNA 为载体或靶向目标的药物称为核酸药物。
目前所有成药的靶点中,蛋白质为药物靶点的主要类型,蛋白的立体结构为小分子药物提供了结合位点,但因为蛋白质结构的复杂性,仍然存在不可成药或者难以成药的问题。如果以 RNA 或 DNA 为靶点,不仅能够扩大用于治疗疾病的靶点比例,同时还具有解决"不可靶向"、"不可成药" 难题的巨大潜力。

图 1. 核酸药物与小分子化合物,抗体的比较 [2][4]
核酸小干扰 RNA (siRNA),反义核酸 (ASO),适配体 (aptamer) 以及 mRNA 疫苗和 mRNA 药物是当前临床核酸药开发的主要形式。之前,我们已经简单介绍过 siRNA 等小核酸药物 (见推文: RNA 治疗——带来无限可能性 ),今天小 M 的目光将聚焦:当红顶流——mRNA 疫苗 。
mRNA 疫苗 实际已研究多年,包括在开发寨卡、狂犬病和流感疫苗过程中;2020 年底 Moderna 首款 mRNA 疫苗 (mRNA-1273) 的获批上市,为新冠疫情防控贡献出一份力量。宾夕法尼亚大学的 2 位科学家 Katalin Karikó 和 Drew Weissman 因研发了"工程改良的 RNA 技术,使新冠疫苗的快速开发成为可能,推动了 mRNA 疫苗在新冠疫情中的研发和使用" 被颁发 2022 年科学突破奖。

图 1. mRNA 的疫苗开发的开创性步骤[3]
关于 mRNA 疫苗的临床试验表明,它们能够提供持久的免疫反应。mRNA 疫苗不是活病毒疫苗,不会干扰人类 DNA。
mRNA 疫苗主要包含合成的 mRNA 分子,这些分子指导抗原的产生,从而产生免疫反应。
目前主要有两种主要类型的 RNA 疫苗开发:非复制 mRNA (NRM) 和病毒衍生的自我扩增RNA (SAM) 疫苗 。传统的非复制 mRNA 可编码感兴趣的抗原并包含 5' 和 3' 非翻译区 (UTR),而自扩增 RNA 不仅编码抗原,还能编码病毒复制机制,从而使细胞内 RNA 扩增和蛋白质表达丰富的病毒复制机制来放大免疫反应。

图 2. 体外转录 (IVT) mRNA 的结构
(IVT) mRNA 模拟内源性 mRNA 的结构,分五个部分: 5ʹ cap、5ʹ非翻译区 (UTR)、编码抗原的开放阅读框、3ʹ UTR 和 poly(A) 尾巴。其中 mRNA 开放阅读框是最关键的组成部分,因为它包含翻译成蛋白质的编码序列。
疫苗的作用机制:依赖人体的体液免疫和细胞免疫
适应性免疫反应由产生抗体的 B 细胞 (体液免疫) 和 T 细胞 (细胞免疫) 介导。疫苗可诱导抗体提供保护,并且使得免疫细胞产生记忆,免疫记忆使免疫系统能够识别并在以后对相同病原体的暴露做出快速反应。编码抗原序列的 mRNA 疫苗可通过脂质纳米载体等递送方式被引入细胞,然后人体细胞通过翻译产生抗原,从而激活免疫反应。与传统疫苗相比,mRNA 疫苗通过内源性表达抗原蛋白,诱导更为广泛有效的细胞免疫及体液免疫反应,产生更高的保护率。

图 3. mRNA 疫苗引发免疫反应[9]
(1) 注射的 mRNA 疫苗被抗原呈递细胞内吞。(2) mRNA 脱离核内体进入胞质溶胶,被核糖体翻译成蛋白质刺激免疫系统。(3) 细胞内抗原被蛋白酶体复合物分解成更小的片段,这些片段被 MHC-I 类蛋白呈递给细胞毒性 T 细胞。(4) 活化的细胞毒 T 细胞通过分泌穿孔素和颗粒酶来杀死被感染的细胞。(5) 分泌的抗原可以被细胞摄取,在内体中降解,并通过 MHC II 类蛋白呈递到细胞表面给辅助 T 细胞。(6) 辅助性 T 细胞通过刺激 B 细胞产生中和抗体以及通过炎性细胞因子激活吞噬细胞来促进循环病原体的清除。
裸 mRNA 注射已成功用于体内免疫,特别是优先靶向抗原呈递细胞的形式,但这种递送方式的效率较弱,且裸 mRNA 在注射后往往会迅速降解。解决 mRNA 疫苗的传递效率是重中之重。
借助常见的物理方法,如电穿孔、基因枪、微针等,可提高裸 mRNA 抗原呈递的效率。但是物理方法可能会使得细胞死亡增加和对靶细胞或组织的进入的限制。
(2). DCs 输送系统的离体装载: 通过在体外将编码肽、蛋白质或其他抗原的 mRNAs 转染到 DCs 中,然后将加工后的 DCs 转移回宿主体内以启动抗原特异性免疫反应。这种方法具有细胞特异性和高转染效率,但是成本较为昂贵。
(3).鱼精蛋白是一种具有树脂状结构的碱性阳离子蛋白质。将不同质量比的 mRNA 与鱼精蛋白结合可产生不同直径的静电鱼精蛋白-mRNA 复合物颗粒。这种紧密结合的形式有效保护 mRNA 不被血清 RNases 降解,且复合物可以引起 DC、单核细胞、B 细胞、自然杀伤细胞和中性粒细胞等免疫细胞的强烈免疫反应。
当前,mRNA 疫苗递送更倾向于使用基于脂质或聚合物的纳米颗粒作为有效且多功能的递送载体。基于脂质的纳米颗粒 (LNP) 是目前临床上最先进的 mRNA 递送载体。截至 2021 年 6 月,所有正在开发或批准用于临床的 SARS-CoV-2 mRNA 疫苗大多采用脂质纳米颗粒 (LNP) 作为 mRNA 递送载体。

图 4:不同的 mRNA 阳离子载体及其成分[9]
a. 脂质纳米颗粒,成分:可离子化脂质、胆固醇、辅助磷脂和聚乙二醇化脂质,LNP 将 mRNA 包裹在其核心中。b. 复合物和聚合物纳米粒子:与 LNP 有相似的优势并能有效地传递 mRNA 。c. 阳离子纳米乳液:纳米乳液由一个油性角鲨烯核心组成,该核心由一个脂质壳稳定,该脂质壳将 mRNA 吸附到其表面。
传染病疫苗: 目前正在开发的 mRNA 疫苗主要可分为 2 大类:预防性疫苗、治疗性疫苗。COVID 疫苗是针对传染病的预防性疫苗,尽管国内已有效果显著的灭活疫苗用于注射,但 mRNA 国产赛道正在进入高速发展起飞,如下图 5 为国内针对新冠疫苗的研究进展。
在针对新冠病毒的疫苗之外,多款针对其他病毒的 mRNA 疫苗也已进入临床开发阶段,用于预防巨细胞病毒 (CMV)、寨卡病毒、呼吸道合胞病毒 (RSV)、流感病毒、狂犬病毒等病原体的感染。

图 5:国内 mRNA 疫苗研究状况[9]
癌症疫苗: 与传染病类疫苗相反,针对癌症的 mRNA 疫苗多为治疗性疫苗。 针对肿瘤相关或肿瘤特异性抗原 (TAA 或 TSA) 的 mRNA 疫苗特异性地攻击和破坏过度表达抗原的恶性细胞,并由于免疫记忆而实现慢性治疗作用。 mRNA 疫苗还允许同时递送多种抗原,涵盖各种 TAA,同时引发体液和细胞介导的免疫反应,增加克服疫苗耐药性的可能性。

图 4:体内 mRNA 调控肿瘤的各种策略[11]
包括 (1). 诱导细胞死亡 (2). 结合肿瘤相关树突状细胞 (3). 抑制细胞类型,如肿瘤相关的巨噬细胞 (4). 细胞因子环境 (5).诱导癌症特异性 T 细胞
与其他免疫疗法相比,癌症疫苗提供了特异性、安全和可耐受的治疗 。 如 CAR-T 疗法在治疗血液病方面非常有效,但在治疗实体肿瘤仍存在许多挑战。 mRNA 疫苗助力 CAR-T 疗法: BNT211 是 由 带有 紧密连接蛋白 Claudin-6 (CLDN6) 的 第 二代特异性CAR-T 细胞组成 ,该 CAR-T 细胞与 CAR-T 细胞扩增 RNA 疫苗 (CARVac) 结合使用,可促进 CLDN6-CAR-T 细胞的扩增、实现了对抗实体肿瘤的有效性。 今年的 AACR 会上,BioNTech 公布了靶向实体瘤的 BNT211 的临床试验结果: 16 名患者临床数据表明: 疾病控制率为 86%,总体缓解率为 43%。
总结:
mRNA 疫苗作为一种核酸疫苗,通过将 mRNA 片段注入人体细胞内产生抗原,再由此激发特异性免疫反应,达到形成免疫记忆的效果。新冠疫情的爆发为 mRNA 疫苗的发展带来巨大机遇,但 mRNA 疫苗应用并不局限于此 ,多种 mRNA 疫苗已经在多个临床应用中表现出巨大的治疗潜力,mRNA 疫苗有望为肿瘤免疫疾病及多种传染病的控制带来无限希望。
,多种 mRNA 疫苗已经在多个临床应用中表现出巨大的治疗潜力,mRNA 疫苗有望为肿瘤免疫疾病及多种传染病的控制带来无限希望。
我们尊重知识产权,如您认为本平台所载文章、图片、视频等内容侵犯您的合法权益,请您及时联系我们,我们将依据相关法律法规、平台规则予以处理。







 ,多种 mRNA 疫苗已经在多个临床应用中表现出巨大的治疗潜力,mRNA 疫苗有望为肿瘤免疫疾病及多种传染病的控制带来无限希望。
,多种 mRNA 疫苗已经在多个临床应用中表现出巨大的治疗潜力,mRNA 疫苗有望为肿瘤免疫疾病及多种传染病的控制带来无限希望。