或是夜空中最亮的星——Tau和Aβ配对抗体表位信息解读
众所周知,清晰的表位信息是配对抗体充分发挥其体外诊断性能的基础。《高性能Aβ和Tau配对抗体——助力阿尔茨海默病诊断真正进入IVD时代》发布以来,广受用户关注。近日,百新意生物研发团队对Tau、p-Tau、Aβ的8株抗体进行了较为深入的表位研究。
一、Tau/p-Tau抗体的表位与交叉反应
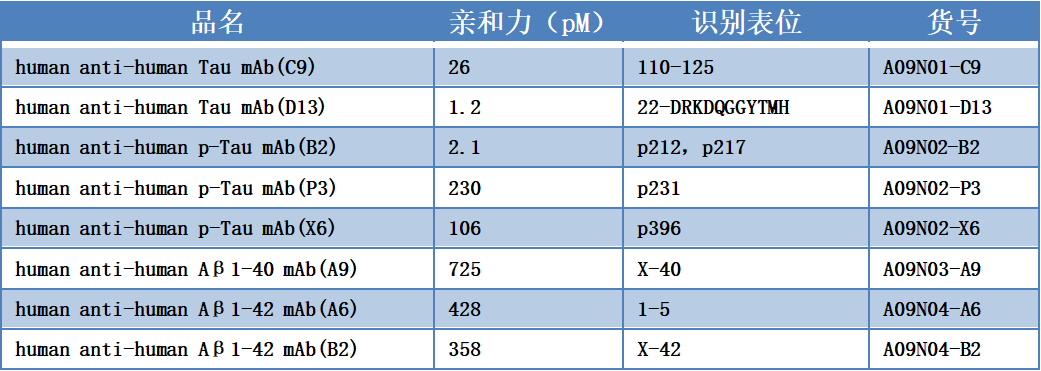
为了明确Tau抗体的结合表位,百新意生物设计了不同长度的截短型Tau蛋白,鉴定其与C9、D13两株抗体的相互作用。结果表明,C9、D13两株抗体识别表位的区域分别为111-125、22-34,如下图所示。

对于p-Tau抗体——B2、P3、X6来说,百新意生物合成了不同位点磷酸化的p-Tau,鉴定其与B2、P3、X6的相互作用。结果表明,抗体B2的识别表位为p212、p217,抗体P3的识别表位为p231,抗体X6的识别表位为p396。
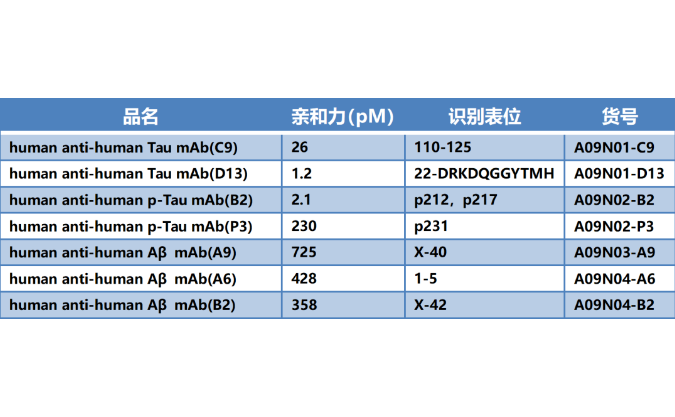
应用BLI技术评估了上述5种抗体与其识别表位之间的亲和力、交叉反应,结果如下表所示。
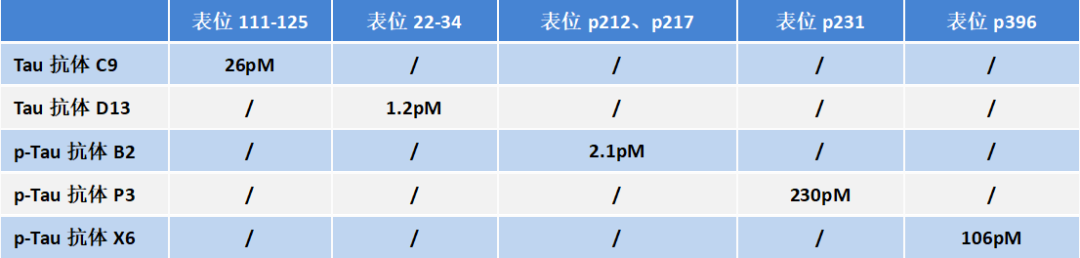
从上表可看出,Tau抗体——C9、D13与p-Tau抗体——B2、P3、X6的特异性均较好,表位明确,互相之间无交叉反应。
目前,针对p-Tau的181、202等其他重要磷酸化位点,相关抗体研发正在进行中,敬请关注“百新意生物科技”微信公众号了解最新进展。
二、Aβ抗体的表位与交叉反应
为了明确Aβ1-40/1-42抗体的结合表位,百新意生物设计了不同长度的截短型Aβ蛋白,鉴定其与A9、A6、B2三株抗体的相互作用。结果表明,A9、A6、B2三株抗体识别表位的区域分别为X-40、1-5、X-42。
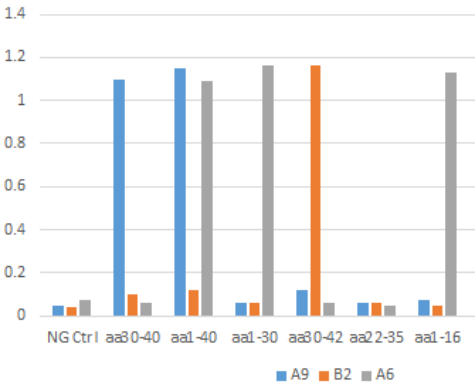
▲ 结果表明,A9仅与Aβ1-40 C末端结合,B2仅与Aβ1-42 C末端结合,A6则两者的N末端均可结合。
应用BLI技术评估了上述三株抗体与其识别抗原之间的亲和力、交叉反应,结果如下表所示。
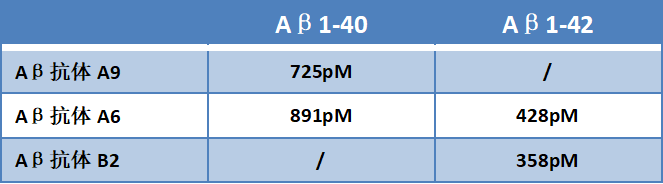
在ELISA方法学体系下,用A9、A6检测Aβ1-40,用A6、B2检测Aβ1-42,检出灵敏度均可达到<5pg/mL。
如果说阿尔茨海默症意味着黑夜,那么准确的早期诊断就好比指路的星光,用于早期诊断的抗体原料则无疑是夜空中最亮的星。
希望在早期体外诊断的助力下,人类能够早日战胜阿尔茨海默病这一顽症。
(备注:百新意不对外提供此文中提到的任一抗原)
咨询
- 478
- 点赞
- 复制链接
- 举报