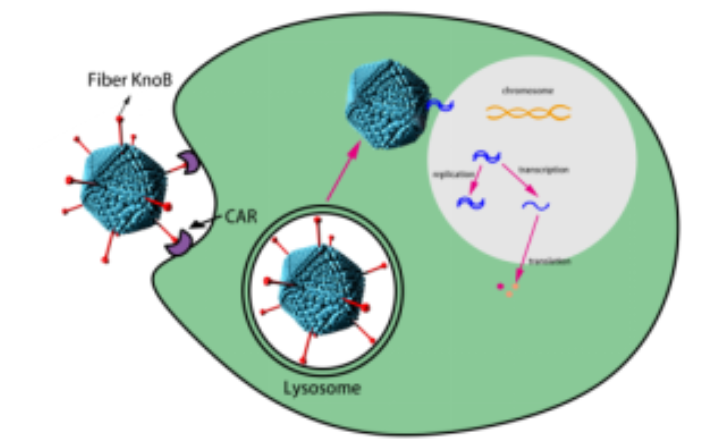
小动物活体成像技术


小动物活体体内光学成像(optical in vivo imaging, OI)是利用高灵敏度的光学检测仪器直接检测动物活体体内的生物发光或荧光信号技术,实现在活体水平上连续动态观测生物体内相关基因的表达、病原体在体内的动态感染、外源性治疗性生物制品在体内靶向分布及代谢的监测等功能。
OI主要采用荧光(fluorescence)和生物发光(bioluminescence)两种技术在活体体内进行不同的生物标记。其中,荧光发光成像技术是将荧光物质或荧光物质标记的小分子物质(基因、小分子药物、抗体、纳米材料等)导入到活体体内,通过小动物活体成像系统的激发光源激发荧光基团达到高能量状态,产生波长较激发光长的发射光,然后通过高灵敏度制冷电荷耦合器件(CCD)镜头探测到活体内的发射光。而生物发光是利用荧光素酶报告基因在活体内表达产生的荧光蛋白与体外注射的荧光素底物发生化学反应而产生荧光,而后同样可经高灵敏度 CCD 镜头探测发光。目前,小动物活体成像已被广泛应用于动态观测活体动物体内肿瘤的生长及转移、免疫性疾病和代谢性疾病的发展过程、特定基因的表达及调控等生物学过程。

1. 细胞培养;
2. 细胞转染;
3. 筛选稳定细胞系;
4. 稳定细胞株荧光素酶活性分析;
5. 稳定克隆体外发光强度的检测 ;
6. 构建小鼠模型;
7. 活体成像系统分析:
① 在待分析的小鼠体腔内注射一定量的荧光素酶的底物Potassium Luciferin (Gold Biotechnology),然后让小鼠自由活动10min,让底物充分随血液循环进入相应所需观察到的位置与荧光素酶发生反应;
② 麻醉:将小鼠放入麻醉盒中,通麻醉气体异氟烷,直到小鼠麻醉完全不动;
③ 检测:将小鼠放入检测室,检测部位朝上放置。先拍摄白光,再拍摄荧光。
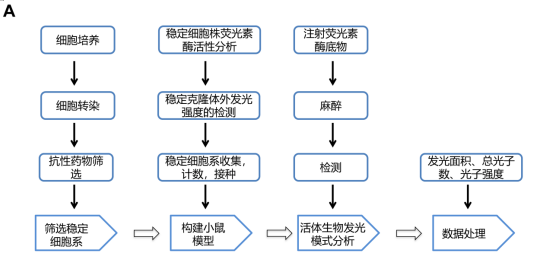

图1 小鼠肿瘤模型活体成像实验流程图
(A)小鼠肿瘤模型生物发光成像实验流程图;(B)小鼠肿瘤模型活体成像仪器外观:1. 影响处理器,2. 435-810nm激光器,3. 808-980nm激光器,4. CMOS传感器,5. 滤器,6. 麻醉剂出口,7. 热感照相机,8. X Y Z工作台;(C)小鼠肿瘤模型活体成像仪器光路(图片资料来源:用于小动物活体得荧光-光热双模成像系统)




肿瘤转移是指癌细胞从原发肿瘤病灶中播散出来,在临近或远处器官生长的现象。
转移的病理生理学核心是癌细胞通过破损的血管内渗和外渗作用,因此完整的血管系统对降低癌细胞的迁移显得至关重要。由于一些纳米颗粒(NPs)可能会导致内皮细胞渗漏(NanoEL),因此设计用于杀死肿瘤的癌症纳米药物也可能无意中导致肿瘤血管系统渗漏,从而导致存活的癌细胞透过血管屏障进入血液循环进行转移。NPs导致的NanoEL发生是由于某些纳米材料通过与血管内皮钙粘蛋白(VE-cadherin)等关键粘附连接蛋白结合而破坏内皮细胞与细胞之间的相互作用。纳米材料结合后,高密度颗粒产生破坏力,破坏VE-钙粘蛋白同源性相互作用。而内皮细胞连接的破坏程度取决于颗粒的大小、固有质量密度和表面电荷。内皮细胞张力的缓解以及细胞内信号传导导致相邻内皮细胞之间出现微米大小的间隙。
本文证明了纳米颗粒通过诱导血管内皮渗漏促进体内乳腺癌细胞的血管内渗和外渗从而促进肿瘤转移与侵袭等恶性行为。作者先将MDA-MB-231-Luc细胞悬液静脉注射入小鼠血管内,然后分别给予1% BSA的PBS(对照组)、5mg/kg或10mg/kg新鲜制备的TiO2NPs处理,每周3次,共10次。4周后,给小鼠注射0.1毫升荧光素(PerkinElmer)后,利用IVIS光谱活体成像系统进行生物发光成像。接着,处死小鼠并收集小鼠组织器官进行生物发光成像。

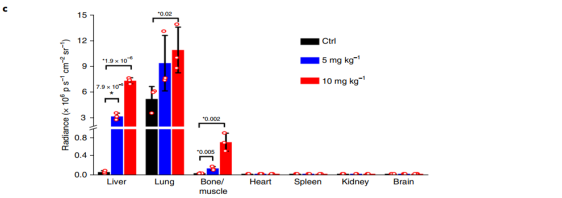
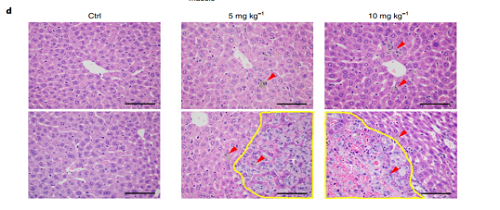
图2 TiO2NPs参与循环乳腺细胞的血管外渗
(A)小鼠的活体成像;(B)TiO2NPs治疗4周后小鼠各组织器官的生物发光;(C)定量分析TiO2NPs治疗4周后小鼠各组织器官的生物发光;(D)与对照组相比,TiO2NPs注射组的巨噬细胞数目和肿瘤负荷存在剂量依赖性的增加。肝脏切片的组织学图像显示:注射TiO2NPs后,中央静脉周围巨噬细胞数目增多(上图)和肿瘤面积的增大(下图)。肿瘤结节(T)用黄线标出。


c-Myc 是细胞增殖的主要调节因子。在癌症中,c-Myc的病理性激活在疾病的发病机制中起着核心作用,其转录程序的协同上调可影响细胞分裂、代谢适应及细胞存活等病理生理过程。Myc拷贝数的增加是癌症基因组中最常见的基因改变之一。溴结构域和额外末端结构域(bromodomain and extra-terminal,BET)蛋白家族具有两个溴结构域和一个额外末端结构域(ET)。该蛋白家族包括BRD2、BRD3、BRD4和BRD5四个成员。BET与乙酰化染色质相关,其可通过增加招募的转录激活剂的有效摩尔浓度促进转录激活。JQ1是一种噻吩三唑-1,4-二氮卓,它通过与乙酰赖氨酸识别袋竞争性结合,取代染色质中的倍溴二胺,是BET-溴结构域蛋白抑制剂。本研究利用JQ1作为化学探针的特性,来研究BET-溴结构域蛋白在Myc依赖性转录中的作用,并探索BET-溴结构域蛋白作为癌症治疗靶点的作用。本文对SCID小鼠静脉注射MM.1S- luc+细胞后,利用小鼠活体成像技术检测到MM(多发骨髓瘤)病变弥漫性植入骨骼后,将50 mg/kg JQ1 或空白对照进行腹腔注射入小鼠体内。活体成像系统显示JQ1可以抑制骨髓肿瘤细胞生长且提高肿瘤小鼠的存活率。

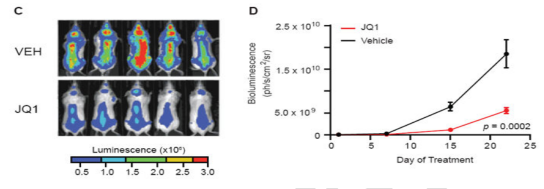
图3 BET溴结构域蛋白抑制剂在多发性骨髓瘤中的作用
(A)JQ1抑制患者来源的原代CD138+MM细胞的细胞增殖;(B)在患者来源的原代MM细胞的短期培养中,JQ1(500 nM,持续时间如图所示)可诱导下调c-Myc蛋白表达;(C)SCID小鼠静脉注射MM.1S- luc+细胞后,在检测到MM病变弥漫性植入骨骼后,将小鼠随机分组并每日分别给予50 mg/kg JQ1 或空白对照进行腹腔注射,小动物活体成像检测小鼠的生物发光强度;(D)利用小动物活体成像检测两组小鼠肿瘤负荷。
![]()
[1] Peng F, Setyawati MI, Tee JK, et.al. Nanoparticles promote in vivo breast cancer cell intravasation and extravasation by inducing endothelial leakiness. Nat Nanotechnol. 2019 Mar;14(3):279-286.
[2] Delmore JE, Issa GC, Lemieux ME, et.al. BET bromodomain inhibition as a therapeutic strategy to target c-Myc. Cell. 2011 Sep 16;146(6):904-17.
[3] Muhammad Naeem, Juho Lee, Murtada A Oshi, et.al. Colitis-targeted hybrid nanoparticles-in-microparticles system for the treatment of ulcerative colitis. Acta Biomater. 2020 Oct 15(116):368-382.
[4] Tianyu Jiang, Xingye Yang, Geng Li, et.al. Bacteria-Based Live Vehicle for In Vivo Bioluminescence Imaging. Anal Chem. 2021 Nov;93(47):15687-15695.
咨询
- 261
- 点赞
- 复制链接
- 举报