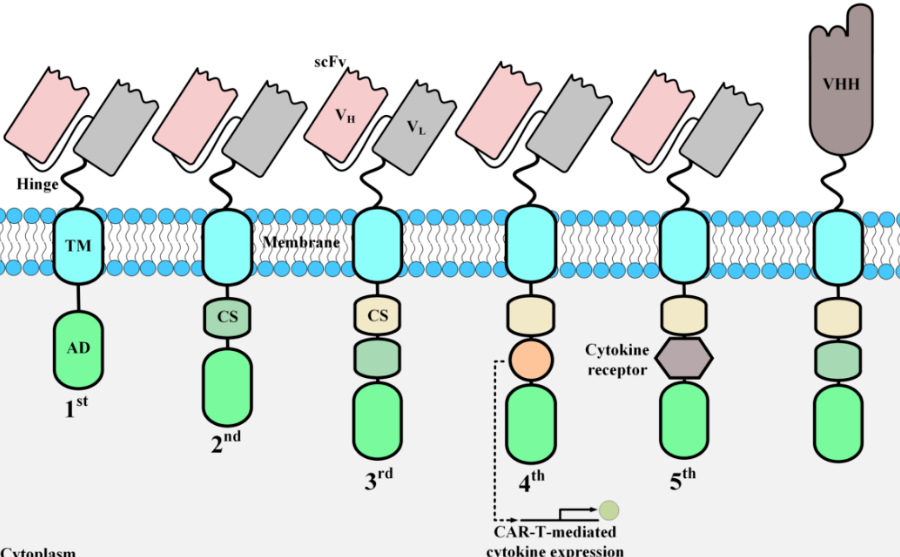
多拷贝基因编辑揭示哺乳动物细胞中H3K27甲基化和乙酰化的特定功能
组蛋白的翻译后修饰(Posttranslational modifications, PTMs)被广泛认为是调节染色质结构和转录所必需的。这一结论主要是通过破坏催化翻译后修饰的酶后间接推断而来【1-2】。然而,最近有研究显示,组蛋白翻译后修饰酶除了组蛋白之外还具有其他非组蛋白底物【3-4】,因此,需要更直接的方法来了解组蛋白PTMs在染色质功能中的作用。
核心组蛋白八聚体亚基H3的N端尾部受到许多PTMs的影响。在黑腹果蝇(D. melanogaster)中,复制组蛋白被组装成单个簇,而与复制无关的组蛋白基因H3.3A和H3.3B分别位于染色体2和X。D. melanogaster中复制组蛋白的这种簇状定位可用于基因置换研究,进而揭示了组蛋白尾部单个氨基酸的功能重要性【5-6】。然而,在小鼠中,编码复制组蛋白H3.1和H3.2的基因分别位于13号和3号染色体上的三个不同的基因组簇中。H3.3由两个基因编码,1号染色体上的H3f3a和11号染色体上的H3f3b。哺乳动物组蛋白基因的分散定位阻碍了哺乳动物细胞中的基因置换研究。
H3K27被认为是染色质相关酶的关键底物。正常发育所需的PRC2负责甲基化H3K27,但它可以甲基化其他蛋白质【4,7】。CBP和EP300乙酰化H3K27,并具有许多其他组蛋白乙酰化底物【8】。尽管已有研究表明H3K27ac与启动子和增强子的活化相关,但依旧缺乏直接证据来证实这种修饰的作用。2022年6月6日,来自丹麦哥本哈根大学的Kristian Helin团队在Nature Genetics杂志上在线发表了题为Histone editing elucidates the functional roles of H3K27 methylation and acetylation in mammals的文章。研究人员在小鼠胚胎干细胞(mouse embryonic stem cells, mESCs)中使用CRISPR碱基编辑构建了pan-H3K27R(pK27R)突变的mESCs(其中H3.1、H3.2和H3.3的所有28个等位基因都已突变),揭示了哺乳动物细胞中H3K27相关PTMs在调节基因表达中的特定功能。结果表明,在mESCs中,H3K27是PRC2的重要底物,而除H3K27乙酰化(H3K27ac)以外的其他PTMs可能参与介导CBP/EP300功能。该研究证实了通过大规模多拷贝基因编辑揭示哺乳动物细胞中组蛋白PTMs功能的可行性。
由于H3.1/2和H3.3可能在部分突变背景下表现出补偿或功能冗余,因此需要pan-H3K27突变体来直接评估H3K27 乙酰化对转录的作用以及 H3K27 是否是哺乳动物细胞中PRC2的关键底物。作者采用了CRISPR-Cas9介导的碱基编辑,利用围绕K27密码子的相同序列设计了通用的gRNA,可同时靶向mESCs(ABE7.10,稳定地表达A-to-G Cas9)中所有复制依赖性基因(H3.1/2)。通过这一方法,作者获得了两个H3.1/2K27R mESCs克隆,命名为cK27R_1和cK27R_2。cK27R mESCs细胞中,H3K27甲基化几乎完全消失,H3K27乙酰化显著降低。随后,作者采用敲除+反向添加(addback)策略构建了pan-H3K27R突变体:敲除cK27R mESCs中的内源性H3.3并分离出表达野生型H3.3(pK27WT)或H3.3K27R(pK27R)的克隆。pK27R mESCs中的H3K27甲基化和乙酰化已无法检测到,但H2AK119ub1、SUZ12、RING1B、EP300和CBP保持不变。
缺乏PRC2的胚胎在原肠胚形成期间死亡。从mESCs产生胚体(embryoid bodies, EB)可重现原肠胚形成,因此,作者检测了H3K27突变对EBs形成的影响。结果显示(1)pK27R中的EBs存活率低且细胞死亡率高;(2)与ABE7.10相比,cK27R EBs和pK27R EBs的形态和大小存在显著差异,pK27R EBs与SUZ12 KO(PRC2 knock-out)EBs类似;(3)pK27WT EBs表现出更好的生存率,并且具有比pK27R EBs更大的尺寸。这些数据表明,在cK27R EBs中现有突变的基础上,H3.3K27对观察到的表型有特异性贡献。
接下来,作者在cK27R和pK27R mESCs中进行了ChIP-seq,绘制了H3.1/2和H3.3对每个H3K27相关PTMs的贡献。大多数H3K27甲基化在cK27R mESCs中丢失,并在pK27R mESCs中进一步降低,证实大多数H3K27甲基化与H3.1/2相关。通过使用两种独立的单克隆抗体,作者观察到H3K27ac从cK27R到pK27R mESCs的逐渐丢失,表明启动子乙酰化存在于H3.1/2和H3.3上。H3.3在增强子处对H3K27乙酰化具有主要贡献。RPB1(RNA Pol-II)和转录共激活子MED1的结合仅在基因和增强子处受到轻微影响,表明在mESCs中H3K27对转录机器与染色质的结合是非必需的。
为了确定PRC2介导的基因抑制受其底物H3K27调控的程度,作者在cK27R、pK27R和SUZ12 KO mESCs中进行了RNA-seq。H3K27和PRC2的丢失导致大量基因抑制。通过比较cK27R和pK27R mESCs中显著上调和下调基因的H3K27me3和H3K27ac,作者发现先前存在的H3K27me3水平与H3K27R突变体的抑制水平相关,H3K27甲基化的丢失(而不是H3K27乙酰化的获得)足以在pK27R mESCs中去抑制。这些结果表明,pK27R和SUZ12 KO mESCs具有相似的基因表达模式,H3K27乙酰化对于mESC中的基因表达是非必需的。
在分化时,所有mESCs在48h左右形成EpiLCs特征的外胚层样结构【9】。作者在cK27R、pK27R和SUZ12 KO样品中观察到了naïve多能基因(Rex1和Esrrb)的完全沉默和EpiLC特异性基因(Fgf5、Oct6、Otx2和Wnt3)的诱导。这一观察结果也在全基因组水平上得到了证实,数千个EpiLC特异性转录本被激活。cK27R和pK27R EpiLCs均显示出ABE7.10和SUZ12 KO EpiLCs之间的基因表达谱。基因集富集分析显示,所有样品均与已发表的EpilC特异性基因列表高度一致,表明EpiLC转录本在分化过程中在 H3K27R 突变体 ESCs中被激活。有意思的是,在细胞类型特异性基因和增强子没有H3K27ac的情况下,RPB1依旧可以与染色质稳定结合。最后,作者发现H3K27乙酰化对于EpiLCs分化过程中的转录激活是非必需的。
总的来说,该研究补充并将D. melanogaster中的发现扩展到哺乳动物细胞,更好地阐明了H3K27 PTMs在转录中的直接作用。PRC2是胚胎发育所必需的,其缺失导致H3K27甲基化丢失和启动子/增强子处H3K27乙酰化的获得。H3K27乙酰化的增加被认为是PRC2活性丧失引起的发育失败的病因。而该研究结果表明,情况并非如此,因为H3K27乙酰化的损失对分化过程中的稳态转录或基因激活没有任何显著的影响。该研究还证明了在哺乳动物系统中靶向组蛋白的多拷贝基因编辑的可行性,为直接研究组蛋白PTMs的生物学意义提供了新方法。
原文链接:
https://doi.org/10.1038/s41588-022-01091-2
卡梅德生物拥有成熟的四大核心技术服务平台:
1、稳定细胞系筛选与基础分子生物学平台;
2、抗体工程技术平台;
3、蛋白服务平台;
4、噬菌体展示技术服务平台;
我们成功研发了众多用于科学研究以及新药发现的重组蛋白、抗体、抗体药物靶点蛋白、工业酶、诊断原料等相关试剂,竭诚为您提供服务。
咨询
- 383
- 点赞
- 复制链接
- 举报