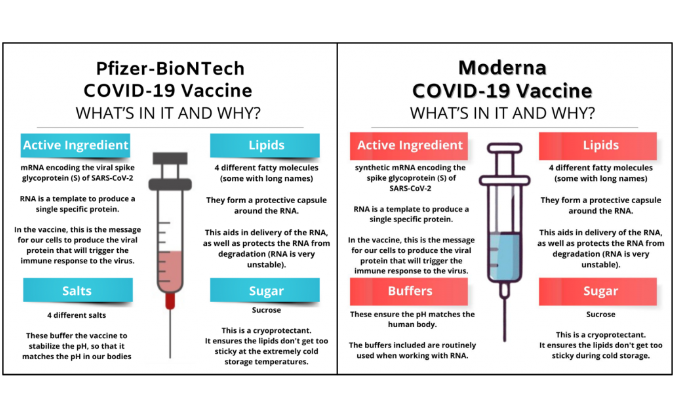
DMG-PEG2000在RNA药物脂质体
这也是为何DSPE-mPEG2000在化药脂质体中常用而核酸类脂质体药物使用DMG-PEG2000的基因沉默/表达水平更高、药效好。
PEG2000-C-DMG 在chu方中的作用一是防止粒间聚集,二是利用PEG2000的“隐形”作用实现长循环及被动靶向。那为何不用DSPE-PEG2000而是要费劲研制一个新辅料呢?根据原研公司Alnylam的研究,chu方所用PEG化脂质的类型和数量不仅决定了脂质体的粒径大小,更会强烈影响基因沉默能力,明显DSPE在这一点上相较于C-DMA是不具有任何优势的。
PEG2000-C-DMG 可降低脂质体与细胞间的相互作用及吸附ApoE的能力,同时,使用含有短酰基链(C14的M)的聚乙二醇脂质,可在实现体内逃逸的同时快速解离,体内半衰期<30min,获得zui佳的肝细胞基因沉默效果。
DMG-PEG2000英文全名1,2-dimyristoyl-rac-glycero-3-methoxypolyethylene glycol-2000,中文名可对应翻译为二肉豆蔻酰甘油-聚乙二醇2000。
它的分子式为C122H242O50,分子量2509.2(平均值),结构如下:
从结构式上就能看出,该材料是通过PEG化修饰了一种短链脂质,C14比常见的DSPE-mPEG2000的C18链短得多,这样直接的结果就是脂质“锚”嵌插入脂质膜较“浅”,在体循环过程中较易脱落。而这一设计的优势是解决了“PEG-dilemma”。
PEG-dilemma 主要有三点:
1、 PEG链的空间位阻作用屏蔽脂质体与细胞膜间的相互作用,yi制靶细胞对脂质体的摄取;
2、 屏蔽脂质体与内涵体膜间的相互作用,妨碍 “内涵体逃逸”,导致 RNA被降解无法顺利进入细胞质;
3、 多次注射 PEG 化脂质体诱发免疫反应,引起加速血液清chu(ABC)现象。
一般的解决办法有:降低脂质体表面PEG 的密度;使用可断裂的 PEG-脂质间linker,如酯键、腙键、肽键;使用短链脂质,如采用C14脂质锚定较C18更易于 PEG 从粒表面解离。
另外,DMG-PEG2000的短链(肉豆蔻酸,C14)比长链(硬脂酸,C18)半衰期小可更快降解,DMG-PEG2000可降低脂质体与细胞间的相互作用及吸附ApoE的能力,获得好的细胞基因沉默效果。
“溶酶体/内涵体逃逸”是RNA类药物递送的关键也是难点,药效高低与其直接相关。使用含有短烷基链的聚乙二醇脂质,可在实现体内逃逸的同时快速解离,以此对抗PEG化造成的“内涵体逃逸”失败现象。
这也是为何DSPE-mPEG2000在化药脂质体中常用而核酸类脂质体药物使用DMG-PEG2000的基因沉默/表达水平更高、药效好。
基于这样的考虑还开发了很多新PEG化脂质,如DMA-PEG2000、PEG2000-Ceramide-C14等,大家在科研工作中可以根据需要选用。
咨询
- 199
- 点赞
- 复制链接
- 举报