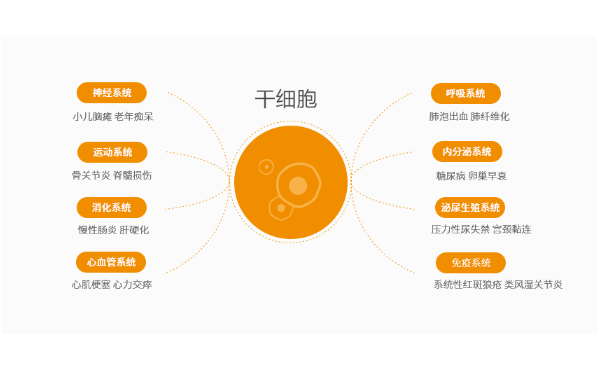
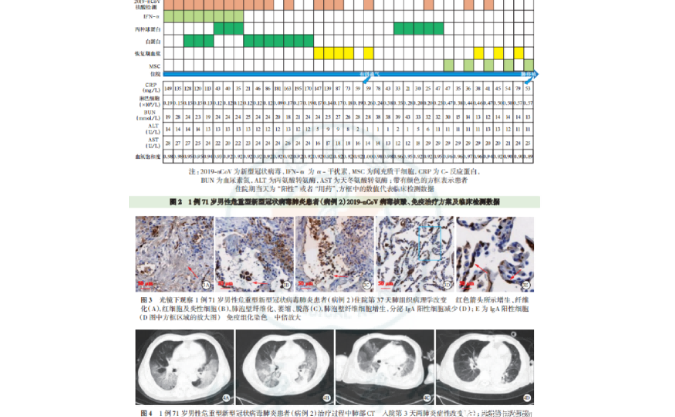
科研资讯丨美国 FDA 授权的具有里程碑意义的 MSC 帕金森病试验
2021 年 4 月 28 日,德克萨斯州 SUGAR LAND — 休斯顿地区的非营利性希望生物科学干细胞研究基金会 (HBSCRF) 已获得 FDA 授权,进行一项 II 期双盲安慰剂对照临床试验,以评估多次静脉输注的有效性和安全性自体脂肪来源的间充质干细胞改善帕金森病患者的日常生活活动和生活质量。
该试验是全球首个在重复治疗中大量使用纯脂肪来源的间充质干细胞给帕金森病患者的试验。24 名患者将随机接受 6 次静脉输注,每人 2 亿个干细胞。
“这是我们针对帕金森氏症的第三项 FDA 授权研究,”HBSCRF 创始人 Donna Chang 阐述道。“前两个是 FDA 授权的扩展访问、单一患者研究。从这些中,我们了解到干细胞的剂量和周期会产生显着的结果,因此能够非常慎重地设计这个更大的临床试验。这正是临床研究发挥最佳作用的方式——每位患者都提供了更深入的理解。我们希望这项更大规模的试验将证实我们在扩大可及性研究中看到的内容,并帮助更多人和家庭获得治疗。”
迄今为止,HBSCRF 的第一位帕金森病患者已经接受了 20 多次输注,体验了该研究的主要调查医生所说的日常生活活动“显着改善”。患者不再需要 24 小时看护,监督治疗的神经科医生表示患者“没有疾病迹象”。HBSCRF 的第二名帕金森病患者本周接受了第三剂干细胞。
“干细胞是退化性疾病的希望,但只有持续给予健康、新鲜、有活力的细胞才能取得成功,”Chang 继续说道。“我们终于克服了细胞治疗的主要障碍。现在我们必须弄清楚需要多少剂量才能提供一致的结果。我们只是触及了这些细胞潜力的表面。”
参与者可以是男性或女性,年龄在 18-75 岁之间,并且必须在开始前至少六个月被诊断出患有轻度至中度帕金森氏症。没有任何费用,但由于这是一项自体研究,因此患者必须在进入试验之前将其细胞储存起来才有资格。
迄今为止,HBSCRF 已获得 FDA 授权,在 10 个疾病领域进行了 17 项临床研究,去年为患者零收费管理了近 1000 亿个细胞。
摘自毕特博生物公众号
咨询
我们尊重知识产权,如您认为本平台所载文章、图片、视频等内容侵犯您的合法权益,请您及时联系我们,我们将依据相关法律法规、平台规则予以处理。
关键字
- 238
- 点赞
- 复制链接
- 举报