细胞侵袭实验全步骤解析
实验材料准备: 细胞,可拍照的显微镜,Transwell小室,孔径8μm,没包被胶的Transwell,迁移实验的细胞培养板24孔板。细胞培养板应当与购买的Transwell小室相配套,BD公司的Matrigel,无血清的基础培养基,BSA,正常的完全培养基,无菌PBS,棉签,胰酶,4%多聚甲醛固定液或者甲醇,结晶紫染液(0.1%PBS结晶紫)
实验材料准备:
细胞,可拍照的显微镜,Transwell小室,孔径8μm,没包被胶的Transwell,迁移实验的细胞培养板24孔板。细胞培养板应当与购买的Transwell小室相配套,BD公司的Matrigel,无血清的基础培养基,BSA,正常的完全培养基,无菌PBS,棉签,胰酶,4%多聚甲醛固定液或者甲醇,结晶紫染液(0.1%PBS结晶紫)
Transwell操作步骤
01
用BD公司的Matrigel 1:8或者根据细胞产生mmp的量来决定稀释,包被Transwell小室底部膜的上室面,置37℃30min使Matrigel聚合成凝胶。使用前进行基底膜水化。
02
制备细胞悬液前可先用基础培养基加1%的血清培养细胞,让细胞饥饿12-24h,进一步去除血清的影响。
03
消化细胞,终止消化后离心弃去培养液,(用PBS洗1-2遍),用含0.1%的BSA的无血清培养基重悬及调整密度,通常调整细胞密度至5×10^5cells/ml。
04
取细胞悬液100μl加入Transwell上室, 也可以根据细胞生长速度进行调整,操作小提示:接种剂量不同的细胞,其侵袭能力是不同的,细胞量过多,穿过膜的细胞会过多过快,最后会难以统计结果;而细胞量过少,可能还没到检测的时间点,所有的细胞都已穿过,进入下室。因此最少也要保证在收样的时候,上室内还要有一定量的细胞存在。
05
24孔板下室一般加入600μl含生长因子或血清的完全培养基,特别注意的是,下层培养液和小室间常会有气泡产生,一旦产生气泡,下层培养液的趋化作用就会减弱甚至消失,种板时一旦出现气泡,要将小室提起去除完气泡,再将小室放进培养板。若是平行孔,一般设置两组.
06
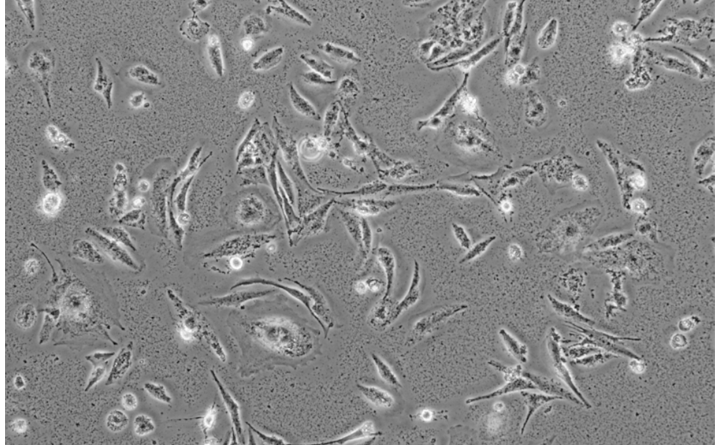
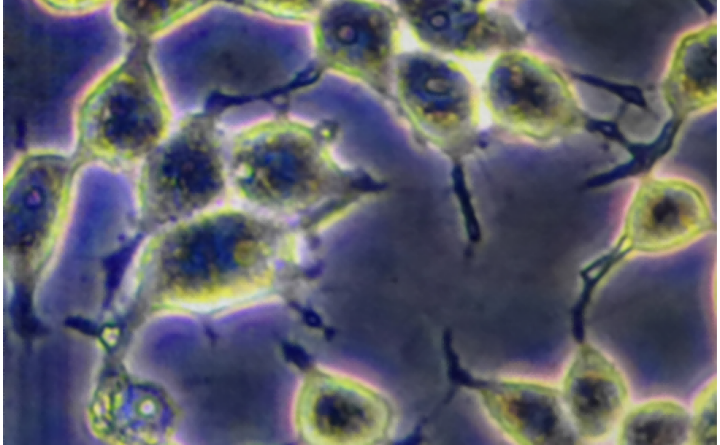
培养细胞:常规培养12-48h(主要依细胞侵袭能力而定)。24h较常见,时间节点的设置除了要考虑到细胞的侵袭力外,处理因素以及细胞数目的影响也不可忽视。
统计结果步骤:
01
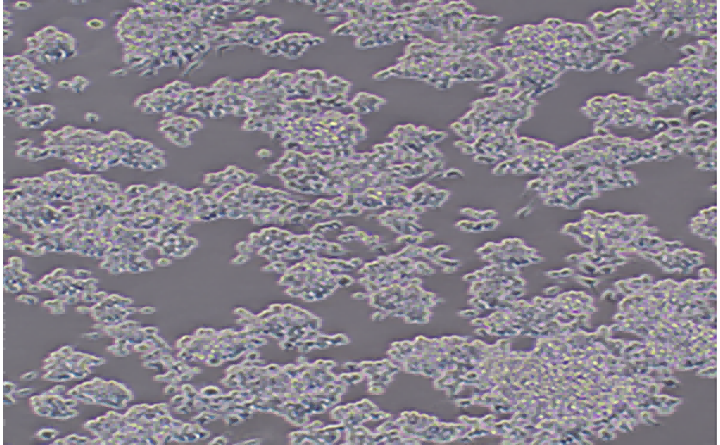
采用直接计数法,取出Transwell小室,弃去孔中培养液,用无钙的PBS洗2遍,甲醇固定30分钟,将小室适当风干。
02
0.1%结晶紫染色20 min,用棉签轻轻擦掉上层未迁移细胞,注意不要蹭到已穿膜的那一层细胞,之后再用PBS洗3遍。
03
400倍显微镜下每个样本取6-10个视野观察细胞计数,取平均值,统计分析。
咨询
- 221
- 点赞
- 复制链接
- 举报