由m6A修饰介导的IRF8的沉默可促进T细胞急性淋巴母细胞白血病的进展
Silencing of IRF8 Mediated by m6A Modifification Promotes the Progression of T-Cell Acute Lymphoblastic Leukemia《Advanced Science》(IF=17.521)

T细胞急性淋巴母细胞白血病(T-ALL)是一种侵袭性的血液系统恶性肿瘤,预后较差,迫切需要寻找新的治疗靶点和治疗策略。
N 6-甲基腺苷(m6A)是一种重要的甲基化修饰,通过调节关键基因的mRNA来影响白血病的发病机制。
干扰素调节因子8(IRF8)是血液谱系定型的关键转录因子,但其在T-ALL中的作用尚不清楚。
这里显示,IRF8可以抑制T-ALL。
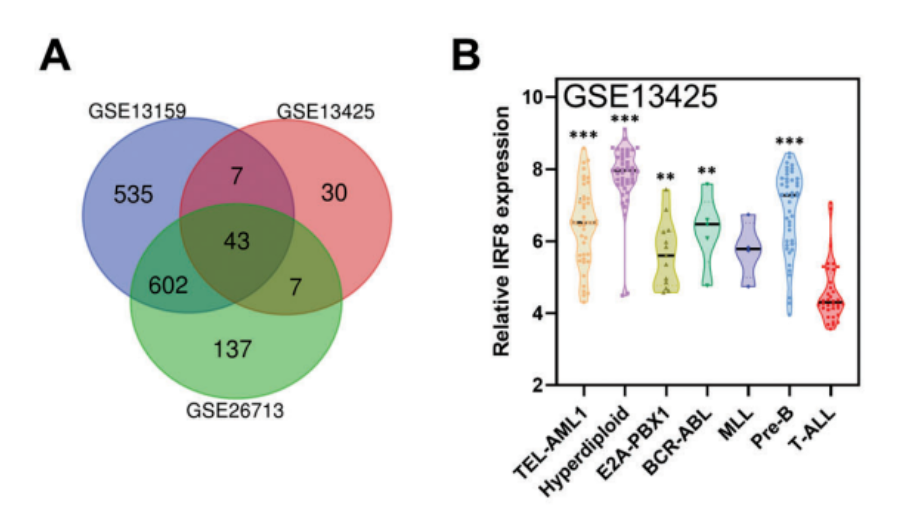
在T-ALL患者中,IRF8的表达异常沉默。
敲除Irf8显著加速了Notch1诱导的T-ALL的进展。
IRF8的过表达通过抑制磷脂酰肌醇3-激酶/AKT信号通路来抑制T-ALL细胞的增殖和侵袭。
脂肪量和肥胖相关蛋白(FTO)是一种m6A去甲基化酶,负责直接结合IRF8信使RNA(mRNA)的3‘非翻译区的m6A位点,并通过m6A修饰诱导mRNA降解。
靶向FTO-IRF8轴被用作概念治疗的证明;抑制 FTO 的去甲基化酶活性可显着减轻白血病细胞的增殖,并通过恢复 IRF8 表达来延长 T-ALL 小鼠的存活期。
本研究从表转录组学的角度阐明了T-ALL的发病机制,并为T-ALL的遗传机制和靶向治疗提供了新的见解。
在本研究中,研究团队证实了IRF8表达的抑制与T-ALL的增殖和侵袭有关。
强制表达IRF8可有效抑制T-ALL细胞的增殖和侵袭,敲除IRF8可通过激活PI3K/AKT信号通路加速Notch1诱导的T-ALL在体内的发展。
功能实验表明IRF8在T-ALL中通过PIK3R5负调控PI3K/AKT通路。
为了进一步研究IRF8在T-ALL中被抑制的原因,并验证IRF8是FTO的下游底物,研究团队对使用FTO抑制剂FB23-2处理的Molt4细胞进行了RNA测序、MeRIP-seq、RIP等实验进行调控机制的深入研究与分析。
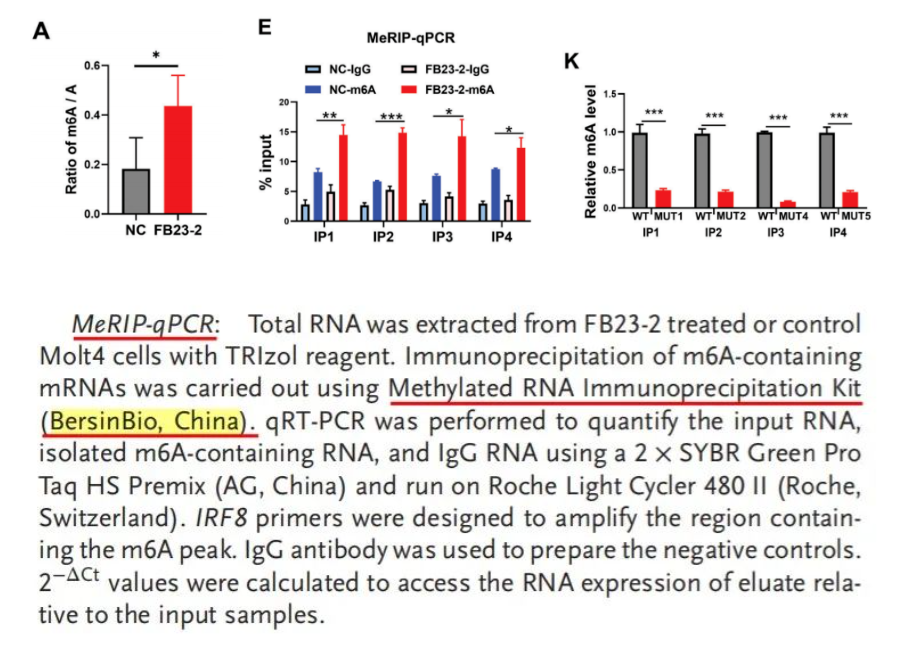
MeRIP-seq数据进一步证实了FTO过表达导致IRF8 3‘UTR的m6A修饰水平的显著抑制;对用或不用FB23-2处理的Molt4细胞进行的MeRIP-seq分析显示,FTO失活导致IRF8 3‘非翻译区(UTR)的m6A水平显著增加。
MeRIP-qPCR分析用或不用FB23-2处理的Molt4细胞中IRF8 mRNA的m6A水平。
MeRIP-qPCR分析HEK293T细胞中野生型IRF8 3‘UTR或突变型IRF8 3’UTR mRNA转录本中的m6A水平。
在这里,研究团队系统地分析了T-ALL中m6A调控因子的表达。
在T-ALL中发现了多种调控因子的异常表达,其中FTO高度上调。
FTO是第一个被鉴定出来的m6A去甲基化酶,它负责消除靶mRNA中的m6A修饰。
T-ALL中高表达的FTO通过影响IRF8 mRNA的稳定性,负向改变IRF8 mRNA的表达,这高度依赖于其m6A催化活性。
FB23-2对FTO m6A去甲基化酶活性的药理抑制成功恢复了体内T-ALL中IRF8的表达,从而通过抑制PI3K/AKT信号通路抑制白血病发生过程。
综上所述,这些结果揭示了IRF8在T-ALL中的抑制作用,并为靶向IRF8 mRNA的外转录组修饰酶提供了一条新的途径,作为克服T-ALL的替代治疗策略。
咨询
- 298
- 点赞
- 复制链接
- 举报





