乳腺癌治疗相关进展
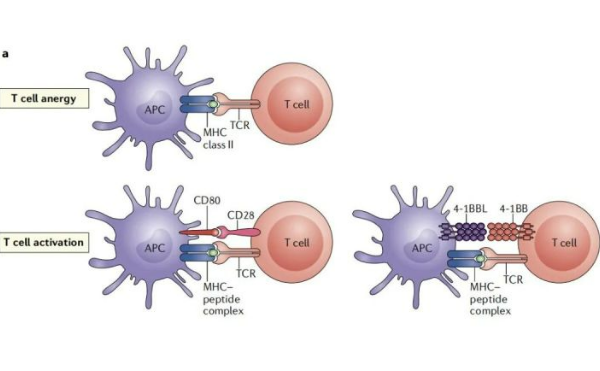
乳腺癌的治疗方法涵盖了从信号传导阻断到免疫系统动员再到疫苗接种等多种机制。 原发性乳腺癌治疗包括手术、放疗、全身化疗、内分泌治疗和/或靶向治疗。根据不同亚型开发不同的治疗方式和药物。
乳腺癌发病率
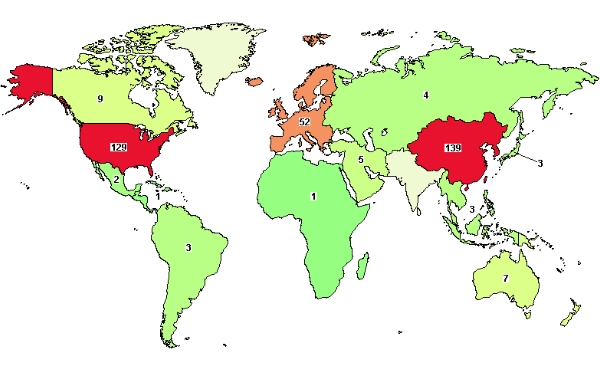
乳腺癌是全球女性最常见的癌症之一。WHO 2020年全球癌症数据显示:
乳腺癌新发病例高达226万例,超越肺癌成为全球第一大癌。据估计,2020年有230万例乳腺癌病例,由此造成的死亡人数大约为68.5万,预计到2070病例将达到440万例。在妇女中,乳腺癌约占所有癌症病例的24.5%,占癌症死亡的15.5%,在2020年世界大多数国家的发病率和死亡率中最高。
在我国,乳腺癌的发病率呈逐年上升趋势,每年有30余万女性被诊断出乳腺癌。
乳腺癌分类
根据激素受体(HR)(雌激素受体(ER)和孕激素受体(PR))和人表皮生长因子受体2(HER2)的表达,临床上将乳腺癌分为 4 类:
乳腺癌通常有四种主要亚型:HER2、Luminal-A (LumA)、Luminal-B (LumB)和三阴性乳腺癌(triple-negative breast cancer, TNBC)。LumA是最常见的乳腺癌亚型,在所有四种亚型中,LumA亚型的预后最好。
|
乳腺癌亚型
|
ER
|
PR
|
HER2
|
|
HER2
|
-
|
-
|
+
|
|
LumA
|
+
|
+
|
-
|
|
LumB
|
+
|
+
|
+
|
|
TNBC
|
-
|
-
|
-
|
乳腺癌各亚型在乳腺癌中的占比,如下图所示:
(数据来源:Breast Cancer Facts & Figures 2019-2020)
根据这个分类来预测乳腺癌的复发转移风险及其对治疗的反应, 是乳腺癌靶向治疗和抗乳腺癌靶向药物开发的基础。
乳腺癌的治疗
乳腺癌的治疗方法涵盖了从信号传导阻断到免疫系统动员再到疫苗接种等多种机制。
原发性乳腺癌治疗包括手术、放疗、全身化疗、内分泌治疗和/或靶向治疗。根据不同亚型开发不同的治疗方式和药物。
HR+乳腺癌
对于激素受体阳性的乳腺癌,其治疗方式主要有:选择性雌激素受体调节剂和降解物(SERMs和SERDs)、芳香化酶抑制剂(AI)和内分泌治疗。但是内分泌治疗存在耐药性问题。其他的治疗方式还包括mTOR抑制剂和PI3K抑制剂。
下表是HR+乳腺癌的主要药物:
(数据来源: New and Emerging Targeted Therapies for Advanced Breast Cancer)
PI3K、Akt和mTOR复合物是PI3K/Akt/mTOR (PAM)通路的主要调节因子,该通路与细胞生长、存活和增殖有关。因此,靶向抑制PI3K、Akt和mTOR激活的疗法正在研究和开发中。
(数据来源:New and Emerging Targeted Therapies for Advanced Breast Cancer)
mTOR抑制剂
目前的mTOR抑制剂包括:Everolimus,Temsirolimus,Sirolimus。
PI3K抑制剂
目前的PI3K抑制剂包括:Alpelisib,Taselisib,Pictilisib,Buparisib。
Alpelisib是一种α-特异性PI3K抑制剂,于2019年5月获FDA批准用于绝经后女性HR+、HER2-的晚期或转移性乳腺癌治疗。
Taselisib是一种选择性I类PI3K抑制剂。与PI3K泛型抑制剂相比,它有更低的毒性和更大的疗效。
Pictilisib和Buparisib均为口服I类PI3K泛型抑制剂。因此可能导致一定的毒性作用,这是泛PI3K抑制的药物局限性。
此外针对PAM通路的天然抑制剂也有很大的意义。比如:
PTEN(磷酸酶和张力素同源物),可将PIP3去磷酸化为PIP2,从而有效逆转PI3K的激活。
LKB1-AMPK通路参与mTOR信号的负调控,上调该通路可直接靶向下游mTOR信号。
HER2+靶向治疗
HER2(也称ERBB2),属于人表皮生长因子酪氨酸激酶受体家族(EGFR/ERB),是一种具有酪氨酸激酶活性的跨膜蛋白受体。HER2过表达在乳腺癌的细胞转化和癌变中至关重要。HER2+乳腺癌占所有乳腺癌病例的20 - 25%。因此靶向HER2是治疗乳腺癌的重要方式。
针对HER2通路的主要靶向疗法包括:单克隆抗体和酪氨酸激酶抑制剂。单克隆抗体主要靶向HER2胞外的受体结合区域,阻断下游信号转导,而酪氨酸激酶抑制剂是小分子,结合并阻断HER2受体胞内的ATP结合区域,防止磷酸化,从而阻断下游信号转导。
(数据来源:New and Emerging Targeted Therapies for Advanced Breast Cancer)
酪氨酸激酶抑制剂(TKIs)
TKIs优于单克隆抗体治疗的几个优势:口服给药、降低心脏毒性和能够针对多个靶点。
靶向HER2的TKIs中,Lapatinib (拉帕尼替)是HER2和HER1的可逆TKI,而Neratinib,Pyrotinib,tucatinib均为不可逆TKI。
Neratinib通过诱导半胱氨酸残基共价连接,抑制HER1、HER2和HER4受体ATP结合域的磷酸化。
Pyrotinib共价结合到细胞内受体ATP结合域,抑制磷酸化和下游通路的激活。
Tucatinib具有高度选择性,对HER2的特异性是EGFR的1000倍。Tucatinib也被发现具有更高的中枢神经系统(CNS)穿透性。
单克隆抗体
单克隆抗体是HER2阳性乳腺癌的有效治疗选择。
Trastuzumab(曲妥珠单抗):这是以HER2为靶点的靶向治疗药物,1998年由FDA批准上市。它与HER2受体结合,抑制HER2同型二聚体或异质二聚体的形成,阻断下游细胞增殖信号。曲妥珠单抗还有助于通过激活免疫系统的抗体依赖细胞介导的细胞毒性(ADCC)来破坏HER2阳性细胞。
Pertuzumab(帕妥珠单抗):Pertuzumab于2017年底被FDA批准与曲妥珠单抗一起使用。帕妥珠单抗和曲妥珠单抗联合治疗对HER2受体形成更完全的阻断,并被发现具有协同作用。
Margetuximab(玛妥昔单抗):FDA于2020年底批准Margetuximab与化疗联合使用,用于增加对HER2阳性细胞的免疫激活。它与曲妥珠单抗作用于相同区域,触发相同的信号阻断,但是玛妥昔单抗的FC是工程化改造的,以增加对激活的Fcγ受体的亲和力,并降低对FcγR抑制受体的亲和力。
ADC
目前,有两种FDA批准的抗体-药物偶联物用于治疗HER2阳性乳腺癌。
T-DM1:T-DM1获批用于HER2阳性乳腺癌的ADC。它是由曲妥珠单抗骨架通过硫醚连接到一种微管抑制剂mertansine。
T-DXd:T-DXd被批准用于治疗HER2阳性乳腺癌。它通过一个可切割的连接物和exatcan相连,Exatecan是一种拓扑异构酶抑制剂。T-DXd具有更高的药物抗体比。
这两种ADC均伴有低度不良反应,包括胃肠道毒性和恶心。
HER2-靶向治疗
HER2-靶向治疗包括:PARP抑制剂,CDK4/6抑制剂和ADC药。
(数据来源:New and Emerging Targeted Therapies for Advanced Breast Cancer)
PARP抑制剂:PARP参与了碱基切除修复,还在维持基因组稳定性方面发挥作用,从而有助于细胞存活。
CDK4/6抑制剂:细胞周期蛋白依赖性激酶(CDKs)是在细胞周期调节中发挥重要作用的蛋白激酶。CDK4和CDK6是G1激酶,调节细胞周期从G1期退出并进入S期。
TNBS
三阴性乳腺癌即雌激素、孕激素和HER2表达均为阴性的乳腺癌。三阴性乳腺癌约占所有乳腺癌人群的15%。因恶性程度高、复发转移风险大、缺少精准治疗靶点,三阴性乳腺癌又被称为“最凶”乳腺癌。
免疫检查点抑制剂(免疫疗法)
已有研究表明,肿瘤浸润淋巴细胞的活化可导致乳腺癌预后较好。乳腺癌中的免疫检查点抑制剂靶向PD-1/PD-L1。PD-1/PD-L1相互作用作为一种调节机制抑制细胞毒性T细胞的激活。阻断PD-1/PD-L1的相互作用可以增加细胞毒性T淋巴细胞的激活,从而可以渗透和攻击乳腺癌肿瘤。
Atezolizumab:靶向PD-L1的免疫检查点抑制剂。
Pembrolizumab:靶向PD-1的免疫检查点抑制剂。
这两个药物都已被批准用于晚期TNBC患者。
ADC
Immune-132是一种抗Trop-2抗体,通过一个可切割的CL2A连接子与SN-38(一种拓扑异构酶I抑制剂)结合。Trop-2表达于乳腺癌细胞中。因此,immune -132可以通过裂解连接子特异性地将SN-38传递到乳腺癌细胞及周围肿瘤。Immune-132能够靶向三阴性乳腺癌细胞。
癌症疫苗
癌症疫苗引入正常组织中不存在的特定肿瘤抗原,从而刺激免疫系统识别和靶向癌细胞中的这些特定抗原;另外,它也可刺激分化阳性(细胞毒性)T细胞的长期记忆簇的产生,以防止复发。
目前针对癌症疫苗在癌症治疗和预防癌症复发的有效性方面做了大量研究。多肽疫苗是乳腺癌疫苗研究的主要焦点。
E75肽疫苗:E75肽疫苗引入了一个来自HER2蛋白胞外结构域的9个氨基酸肽,从而靶向HER2阳性乳腺癌。一项3期临床试验(PRESENT)研究了E75联合GM-CSF免疫佐剂在辅助治疗中预防乳腺癌复发的有效性。然而,E75与GM-CSF联合治疗在预防癌症复发方面没有任何疗效。
GP2:GP2是一种乳腺癌疫苗,被评估可有效降低her2阳性乳腺癌患者的复发率。该疫苗具有临床安全性,但没有显示出显著的治疗益处。GP2来源于HER2蛋白跨膜结构域的9个氨基酸肽。与E75类似,预计GP2与HLA-A2结合激活细胞毒性T淋巴细胞,但其亲和力低于E75。
α-乳清蛋白:α-乳清蛋白只在哺乳期间在乳腺中表达,并且在乳腺癌细胞中异常高表达,尤其是在TNBC中。因此,该疫苗可能对绝经后妇女具有显著的预防和治疗潜力。针对绝经后高危早期TNBC患者的疗效正在1期临床试验。
目前缔码生物围绕血液肿瘤、免疫检查点、实体瘤相关靶标开发出一系列B细胞种子库,通过这些B细胞种子库,满足不同应用抗体筛选需求:如高亲和力中和活性抗体、CAR T-细胞治疗应用相关抗体、阻断或激活性抗体等。以下靶点有预先验证抗体分子可直接验证和引进!极大缩短开发进程。欢迎咨询~
参考文献:
[1] Breast Cancer Facts & Figures 2019-2020
[2] Lau KH, Tan AM, Shi Y. New and Emerging Targeted Therapies for Advanced Breast Cancer. Int J Mol Sci. 2022 Feb 18;23(4):2288.
咨询
我们尊重知识产权,如您认为本平台所载文章、图片、视频等内容侵犯您的合法权益,请您及时联系我们,我们将依据相关法律法规、平台规则予以处理。
关键字
- 117
- 点赞
- 复制链接
- 举报