高分文章分享(1)丨最新发现!它们或许是肿瘤放疗治疗和关节炎患者的福音
IF = 18.027 | 用于加强肿瘤治疗——从二维系统中按需生成过氧亚硝酸盐
放射治疗是一种基于高能辐射直接电离或间接产生细胞毒性活性氧(ROS),致DNA损伤的无创治疗方式,是目前临床应用最广泛的癌症治疗方法之一。
在放射治疗过程中,电离辐射通过外部光束(电子、质子、光子或X射线)或内部放置的放射源(近距离治疗)传递到肿瘤。然而,无论是采用外照射还是近距离照射,由于生物组织器官的X射线衰减系数较低,以及缺氧肿瘤的抗辐射能力,放疗效果受到限制。而且,辐射引起的DNA损伤往往会被肿瘤细胞的DNA修复系统消除,进一步限制了放疗的疗效。因此,开发出更好的放射增敏剂是迫切需要的,一方面使低氧或耐辐射肿瘤增敏,另一方面切断DNA损伤修复途径,增强放疗的疗效。
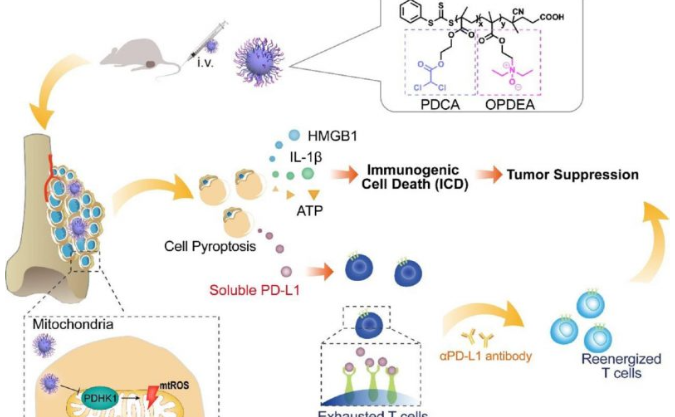
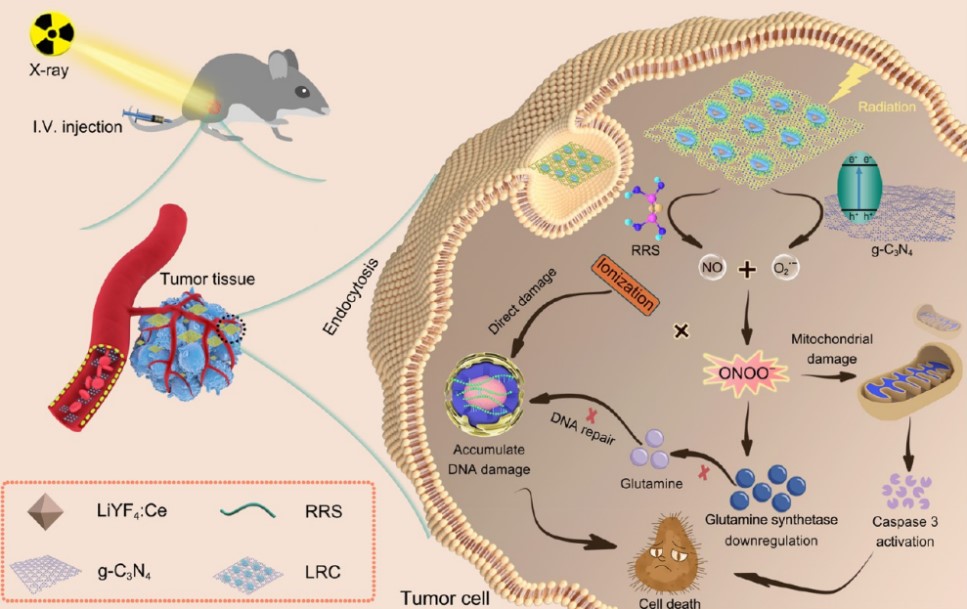
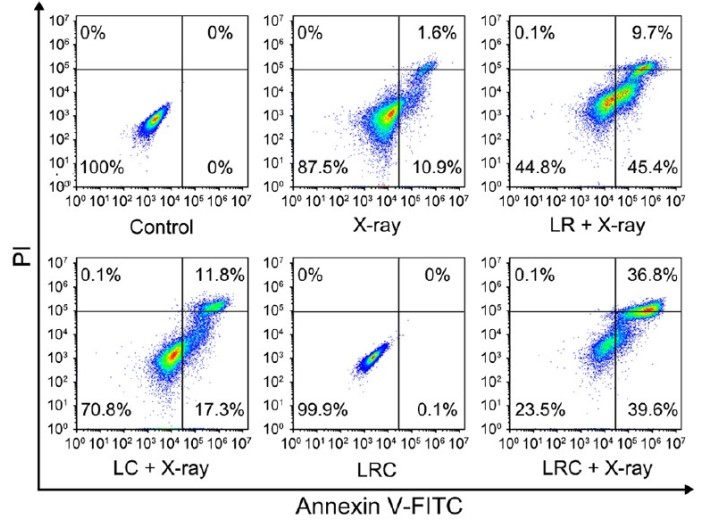
为了开发出放射增敏剂,来自哈尔滨工程大学超轻材料与表面技术重点实验室的研究团队进行了相关研究,在期刊ACS NANO发表了题为On-Demand Generation of Peroxynitrite from an Integrated Two-Dimensional System for Enhanced Tumor Therapy的研究论文。该团队构建了一种多功能系统LRC,该系统以装载了RRS (Roussin’s red salt)修饰的LiYF4:Ce闪烁体的g-C3N4 (graphitic carbon nitride)纳米薄片为基本构架,能够用于X射线诱导的ONOO-生成,增强肿瘤放疗的疗效。
该团队证实,得益于Ce3+的增敏作用,LRC系统可在UV区域发出强荧光,进一步唤醒周围光敏材料,同时释放RRS中的NO和g-C3N4中的O2,从而实现X射线诱导的ONOO-按需生成和释放,用于体外和体内的癌症治疗。借助释放的NO和ONOO-,可以缓解肿瘤缺氧,从而克服放疗中的缺氧相关抵抗。同时,通过提高DNA损伤程度、抑制DNA损伤修复、增强放射增敏作用,有效抑制肿瘤生长。此外,LRC可作为一种优良的CT造影剂,在借助影像的诊断和治疗中具有广阔的前景。
MULTISCIENCE产品支撑
重点来了!该团队使用联科生物(MultiSciences)的Annexin V细胞凋亡检测试剂盒,对实验细胞的凋亡进行了检测分析,获得了很好的检测结果。

IF = 9.429 | NOX4阻断剂通过激活Nrf2信号通路抑制纳米钛诱导的骨破坏
全关节置换术(TJR)是治疗终末期关节炎的重要手术手段。着老龄化人口的增加,接受TJA的患者正在迅速增加。在美国,到2040年,预计每年的全髋关节置换(THAs)总数将达到1429,000例,而原发性全膝关节置换的数量将达到3416,000例。然而,假体周围骨溶解(PPO)和无菌性松动是TJR手术最常见的并发症,几乎是不可避免的问题,导致这些患者的生活质量下降和不稳定风险增加。另外,PPO的作用机制尚未完全阐明,增加了PPO的治疗难度。
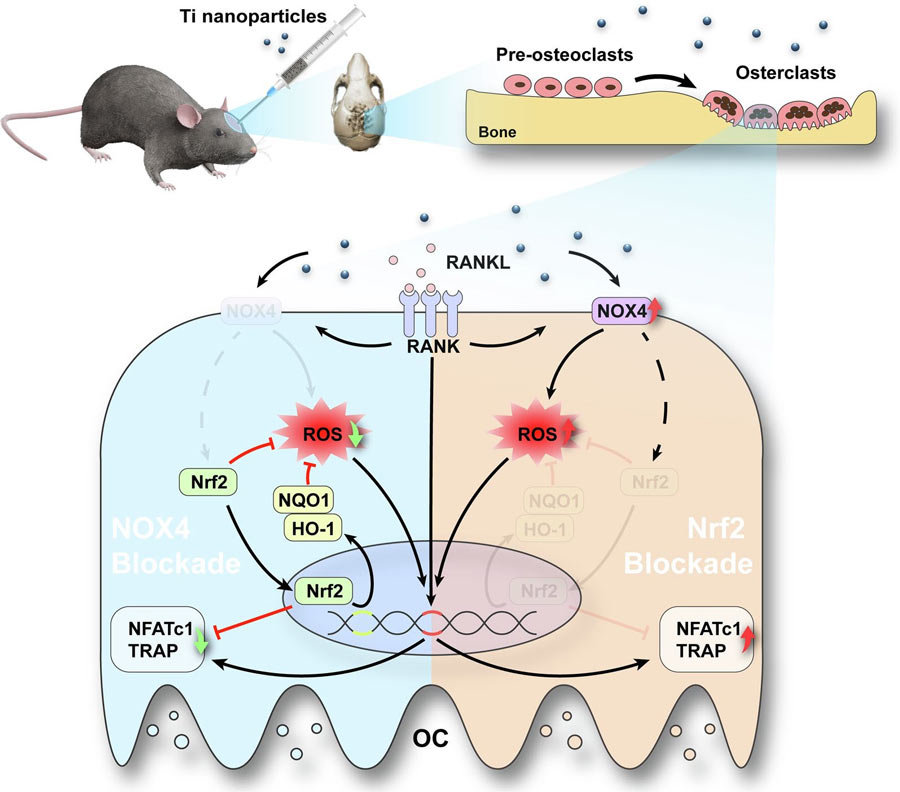
近日,来自苏州大学附属第一医院的研究团队在期刊Journal of Nanobiotechnology上发表了题为:NOX4 blockade suppresses titanium nanoparticle-induced bone destruction via activation of the Nrf2 signaling pathway的研究论文。他们首次阑明了NOX4阻断剂通过激活Nrf2信号通路抑制纳米钛诱导的骨破坏。
该团队报道了NOX4在磨损颗粒介导的PPO中的作用,并通过RANKL诱导的体外破骨细胞生成和Ti纳米颗粒诱导的体内骨溶解模型探讨了可能的机制。结果显示,NOX4阻断剂通过阻止破骨细胞的过度活跃来调节骨吸收。 其机制依赖于活性氧清除增强和核因子-红系2相关因子2 (Nrf2)及其下游信号通路的激活。此外,NOX4阻断剂通过抗破骨活性和抗氧化活性抑制Ti纳米颗粒诱导的骨破坏。这些发现表明,NOX4阻断是一种有吸引力的预防PPO的治疗方法。
咨询
- 282
- 点赞
- 复制链接
- 举报