
神经系统疾病小鼠模型
- CNS
- 百奥动物
- 江苏省南通市
- 现货
- 按需
- 议价
- 2024-08-20 13:25:00
百奥赛图江苏基因生物技术有限公司
- 英文名称
- CNS
- 关键词
- 中枢神经系统血脑屏障阿尔兹海默症孤独症谱系障碍自闭症
中枢神经系统(CNS)相关疾病种类繁多,涵盖了脑血管疾病、神经变性病、免疫性疾病等多个方面。医学上还根据疾病的发生部位进行分类,如脑部疾病、脊髓疾病、周围神经疾病和神经肌肉疾病等。近年来,随着预期寿命的延长,CNS病例数量逐渐增加,这些疾病已被广泛认为是全球主要的健康问题之一。
CNS相关疾病具有明显的复杂性和异质性,动物模型是其研究中必不可少的工具,有助于探索潜在病理和分子机制、识别可能的生物标志物、评估治疗及干预措施疗效,并为候选药物的人体安全和有效剂量提供初步评估。百奥动物开发了一系列神经系统相关疾病小鼠模型,助力临床前药物研发。
血脑屏障
与其他疾病治疗领域相比,CNS药物的开发成本高、周期长且失败率高。在中枢神经系统药物行业中,能够穿过血脑屏障(Blood–Brain Barrier,BBB)的小分子药物非常少。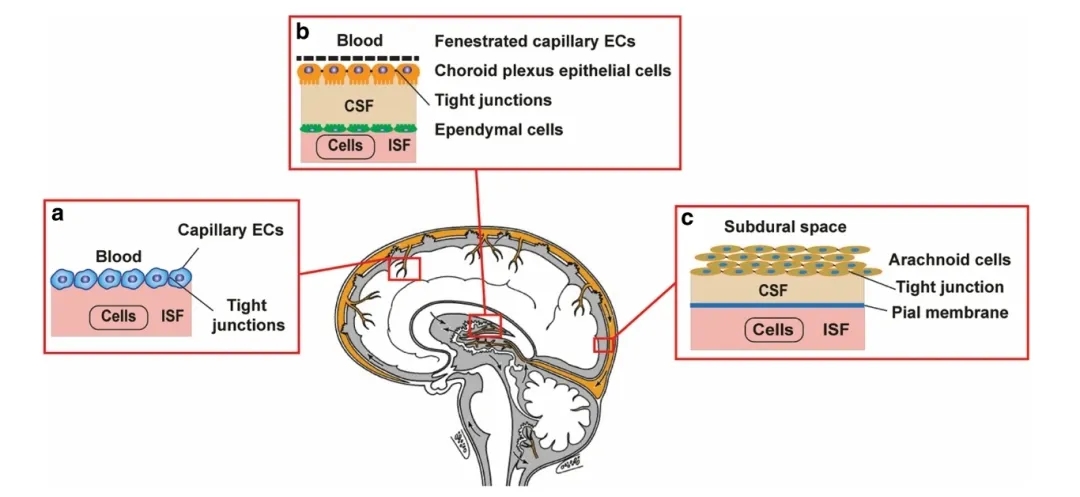
图1.血脑屏障的结构和功能[1]
血脑屏障被认为是介于血液循环和CNS之间的屏障,其结构主要由单层脑内皮细胞、与基底膜相关的周细胞和星形胶质细胞、以及基底膜组成。血脑屏障的功能和结构完整性对于维持大脑微环境的稳态至关重要。
在一项评估超过7000种药物的研究中,只有5%的药物能够穿过血脑屏障并影响中枢神经系统[2]。因此,如何有效地通过血脑屏障递送药物对治疗中枢神经系统疾病至关重要,选择合适的药物递送模型也同样关键。
B-hTFR1 mice
大脑蛋白表达分析
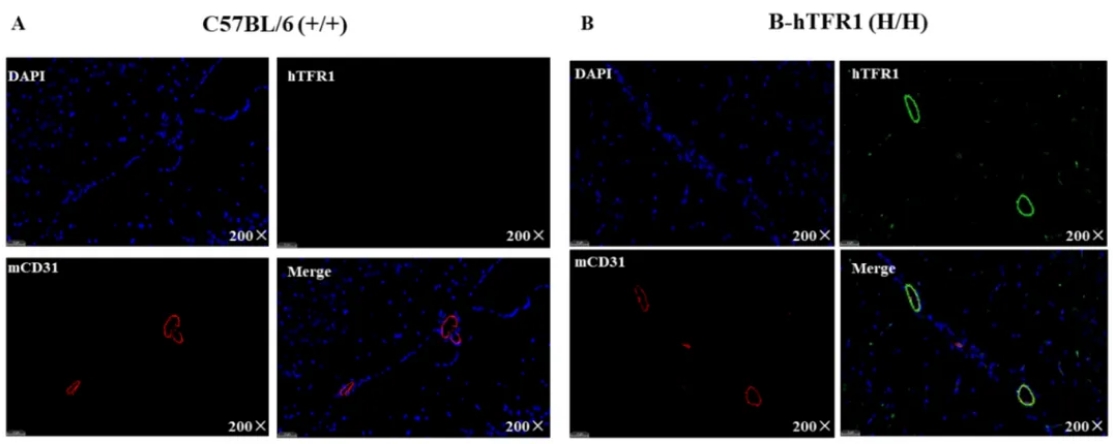
通过免疫荧光染色分析B-hTFR1纯合小鼠的种属特异性TFR1表达。蓝色标记细胞核位置,红色标记mCD31示意小鼠的脑内皮细胞,绿色标记hTFR1,实验结果显示在野生鼠中未检测到hTFR1的表达,而在B-hTFR1 mice中检测到了hTFR1的表达,并且hTFR1表达在脑内皮细胞,该实验结果为靶向药物通过hTFR1的转胞吞作用跨越BBB提供了分子生物学基础。
TFR1 BsAbs的体内PK评价
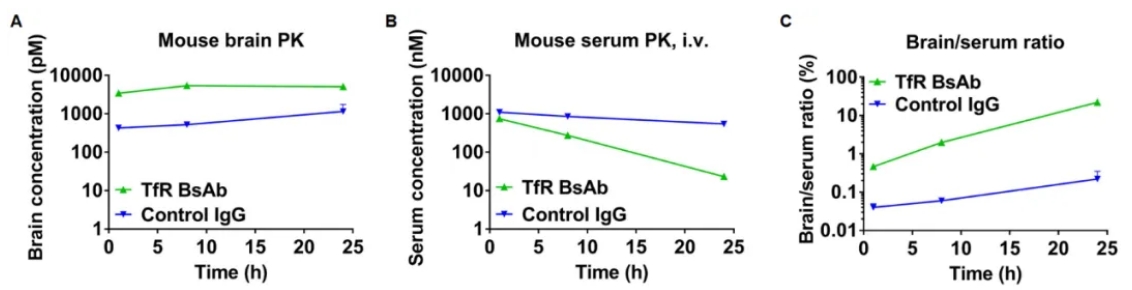
对B-hTFR1小鼠经尾静脉注射对照IgG和抗人TFR1 BsAbs,在不同时间时间点取脑和血清进行体内PK评价,对脑组织和血清中的抗体浓度进行定量检测,并分析脑/血清比。抗人TFR1 BsAbs在给药后表现出更高的血清清除率和增强的脑暴露量。该结果说明静脉给药时,抗人TFR1 BsAbs能够进入B-hTFR1动物脑中。
B-hCD98HC mice
mRNA表达分析
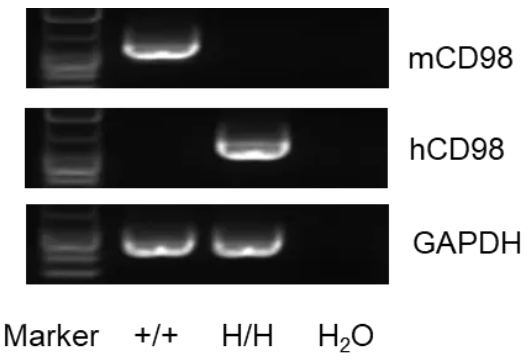
RT-PCR分析CD98基因在野生型小鼠和纯合B-hCD98HC小鼠中的表达。小鼠CD98 mRNA仅在野生型小鼠肾脏中检测到,人CD98 mRNA仅在纯合B-hCD98HC小鼠中检测到,而在野生型小鼠中未检测到。
蛋白表达分析
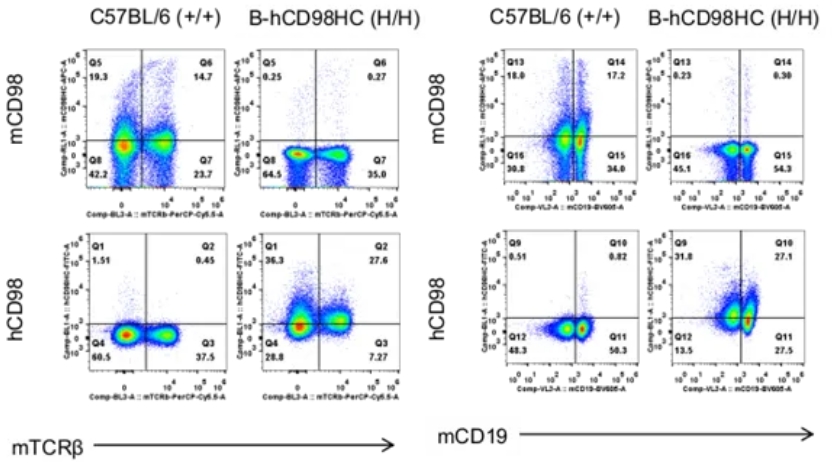
用流式细胞术分析纯合B-hCD98HC小鼠的种属特异性CD98表达。取野生型和纯合B-hCD98HC小鼠脾细胞,用抗CD98抗体进行流式细胞术分析。在野生型小鼠和纯合B-hCD98HC小鼠中检测到鼠CD98。人CD98仅在纯合B-hCD98HC小鼠中检测到,而在野生型小鼠中未检测到。
大脑蛋白表达分析
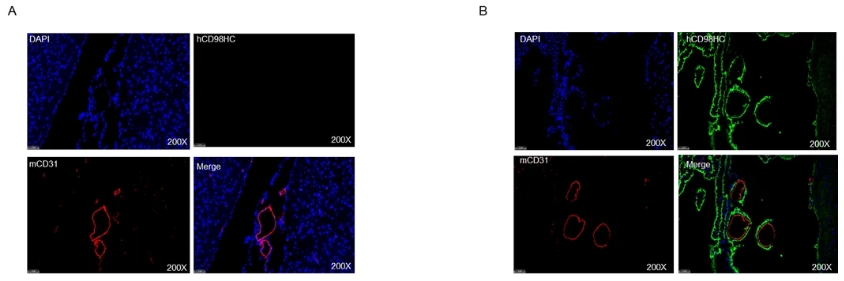
通过免疫荧光染色分析B-hCD98HC纯合小鼠的种属特异性CD98表达。收集野生和纯合B-hCD98HC小鼠(雌性,8周龄)大脑,加工成石蜡切片。用种属特异性抗人CD98HC抗体(绿色)对石蜡切片进行染色。脑组织与抗小鼠CD31抗体共染色以显示微血管内皮细胞(红色)。野生小鼠(A)和纯合B- hCD98hc小鼠(B)的代表性结果如下。结果表明,人CD98只存在于纯合B-hCD98HC小鼠的脑微血管内皮细胞上,而在野生型小鼠的脑微血管内皮细胞上无表达。
BBB相关模型
阿尔兹海默症
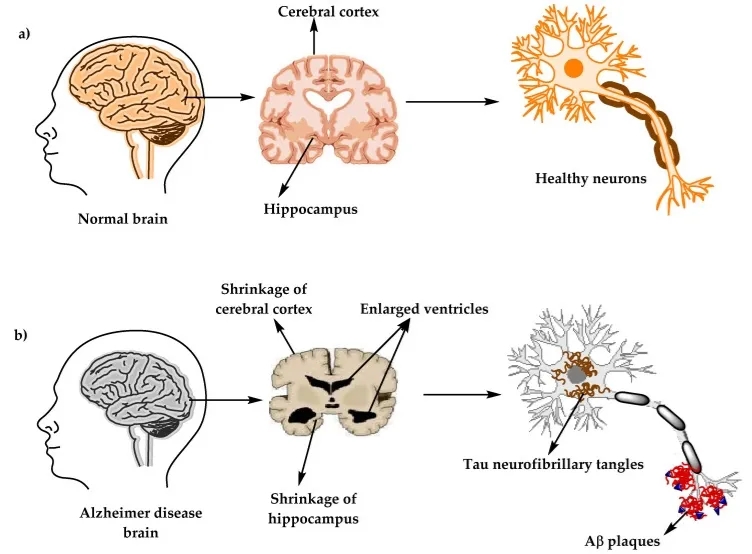
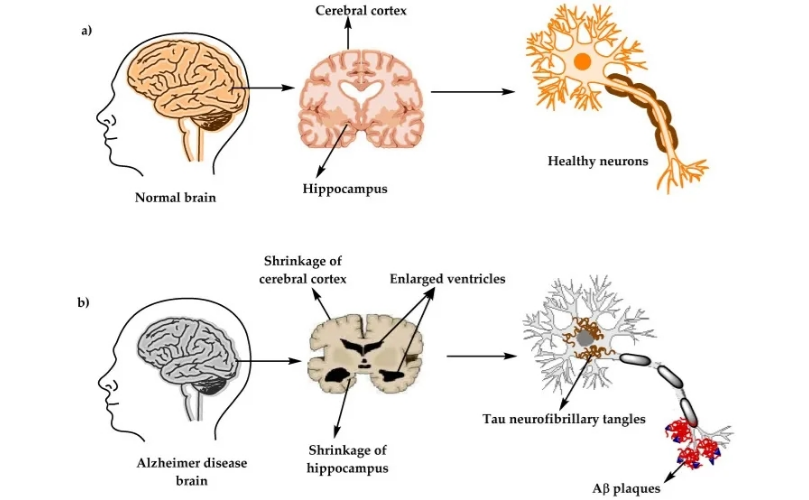
图2.(a)健康大脑和(b)阿尔茨海默病(AD)大脑中的大脑和神经元的生理结构[3]
阿尔兹海默症(Alzheimer Disease,AD)是一种神经退行性疾病,以记忆力、认知能力逐渐下降,并出现精神和行为异常为特征。AD常见的神经病理学变化是细胞外老年斑(Senile plaques, SP)和细胞内神经原纤维的缠结(Neurofibrillary tangles, NFTs)的形成、神经元丢失以及脑萎缩。
目前已知与AD相关的遗传变异有两类:致病变异和风险变异。致病变异是指某些基因突变会直接导致AD发生,这类变异主要与家族性早发型AD有关。已知的致病变异基因有,APP(淀粉样蛋白前体)、PSEN1(早老素1)、PSEN2(早老素2)以及APOE(载脂蛋白E)等。
B-hTAU mice
mRNA表达分析
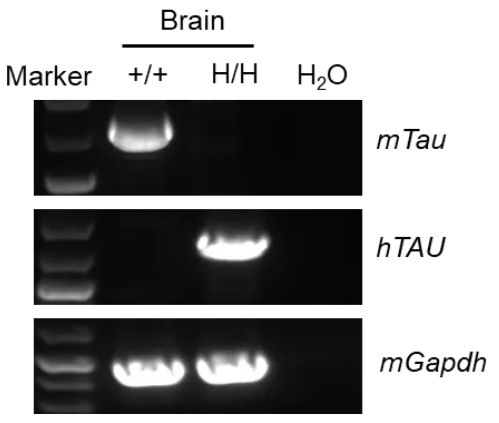
在野生型C57BL/6小鼠的大脑中可检测到小鼠TAU mRNA。在B-hTAU小鼠中可检测到人TAU mRNA。
蛋白表达分析
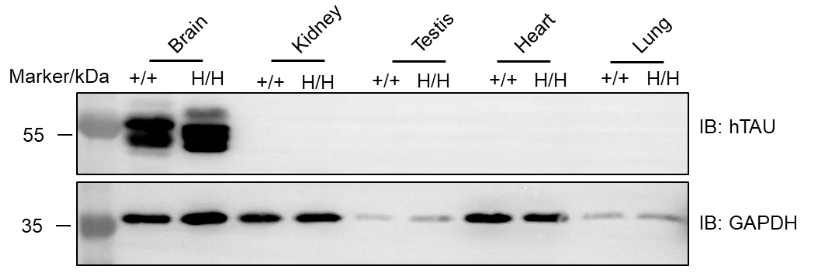
收集野生型C57BL/6小鼠和纯合B-hTAU小鼠的各种组织裂解液,用抗TAU抗体进行western blot分析。提取总蛋白40 μg进行western blot分析。在野生型和纯合小鼠的大脑中均检测到TAU蛋白。
核酸类药物在B-hTAU小鼠体内对人TAU的抑制效果
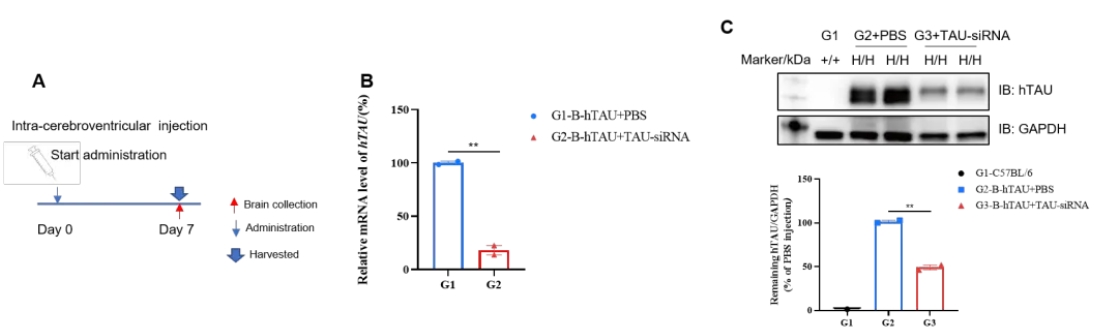
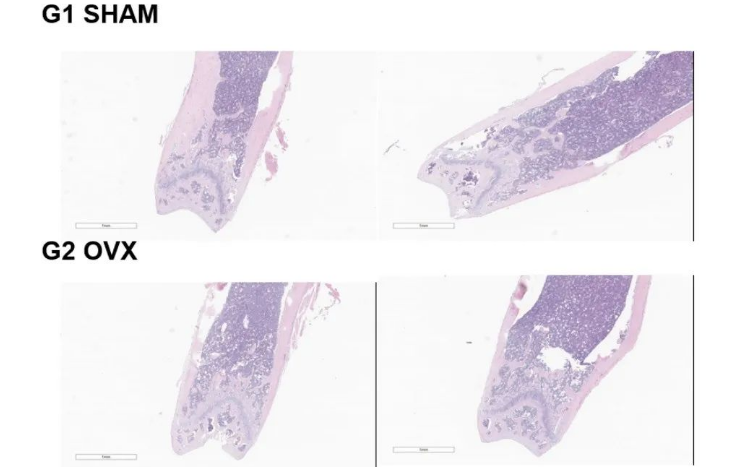
将B-hTAU小鼠随机分为两组(n=2/组,6周大,雄性)。分别给小鼠注射人TAU靶向核酸药物(客户提供)和PBS。第7天处死小鼠,收集脑组织,分别通过qRT-PCR和Western blot检测人TAU mRNA和蛋白的表达。(A) 实验处理示意图。(B) 人TAU mRNA在大脑中的表达。与对照组(G1)相比,治疗组(G2)的人TAU明显减少。(C)人TAU蛋白在大脑中的表达。与对照组(G2)相比,治疗组(G3)的人TAU明显减少,治疗组的抑制率为51.5%,这表明B-hTAU小鼠为人TAU靶向核酸药物的体内评估提供了一个强大的临床前模型。数值以平均值 ± SEM 表示。(验证数据由客户提供。)
B-hTREM2 mice
mRNA表达分析

RT-PCR分析野生型和B-hTREM2小鼠TREM2基因表达的种属特异性。野生型小鼠中可检测到鼠TREM2 mRNA。人TREM2 mRNA仅在纯合B-hTREM2小鼠中检测到,而在野生型小鼠中未检测到。
蛋白表达分析
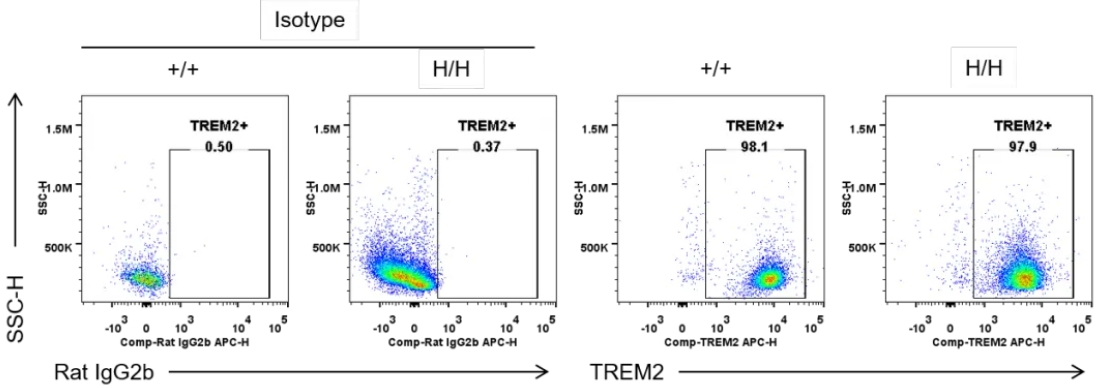
用流式细胞术分析纯合B-hTREM2小鼠的种属特异性TREM2表达。收集野生型和纯合B-hTREM2小鼠的小胶质细胞,用抗tREM2抗体进行流式细胞术分析。在野生型小鼠和纯合B-hTREM2小鼠的小胶质细胞中均可检测到TREM2,因为该抗体在人和小鼠中均与TREM2有交叉反应。
AD相关模型
孤独症谱系障碍
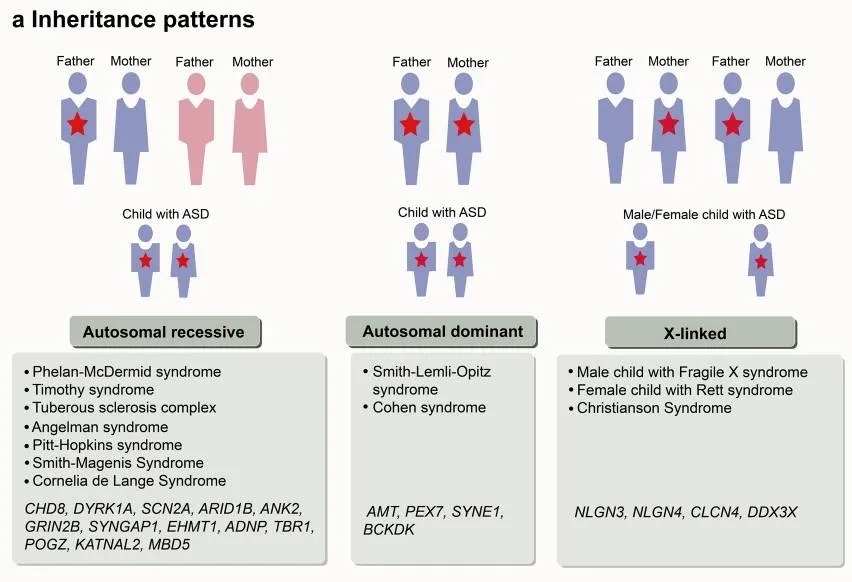
图3. 与ASD相关的高危基因和综合征的遗传模式。[4]
孤独症谱系障碍(Autism Spectrum Disorder, ASD)是一组复杂的神经发育障碍,表现在婴儿早期和儿童期。其特点是社交困难、重复刻板行为、兴趣受限,常伴有感觉和知觉异常。大量研究表明,孤独症谱系障碍是一种由生物学因素导致的神经发育障碍性疾病。其中,遗传因素是最主要的因素,主要基因模式包括常染色体隐性遗传、常染色体显性遗传和x连锁遗传模式。目前ASD的治疗策略分为非药物治疗和药物治疗。将药物治疗与行为社会学习干预相结合可能对自闭症患者的长期治疗产生重大影响。然而,基于孤独症多种病因叠加的复杂机制,目前临床上仍缺乏针对核心症状的治疗方法。
B-Mecp2 KO mice
mRNA表达分析
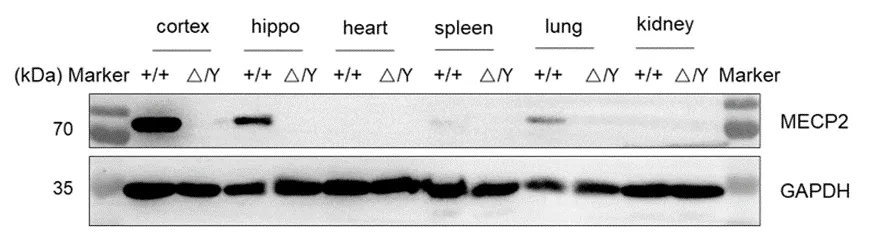
收集野生型C57BL/6和纯合B-Mecp2基因敲除小鼠(△/Y)的各种组织裂解液,用种属特异性抗Mecp2抗体进行western blot分析。提取总蛋白40μg进行western blot分析。B-Mecp2基因敲除小鼠皮质和海马中未检测到Mecp2。
B-Fmr1 KO mice
蛋白表达分析
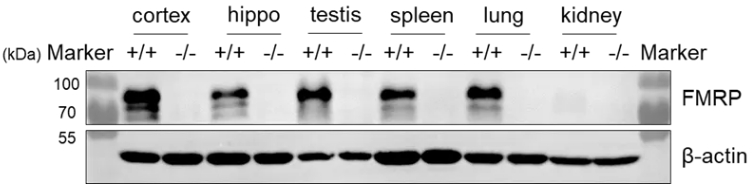
收集野生型C57BL/6和纯合B-Fmr1基因敲除小鼠(-/Y)的各种组织裂解液,用抗FMRP抗体进行western blot分析。提取总蛋白40μg进行western blot分析。在纯合B-Fmr1 KO小鼠中未检测到FMRP。
旷场实验
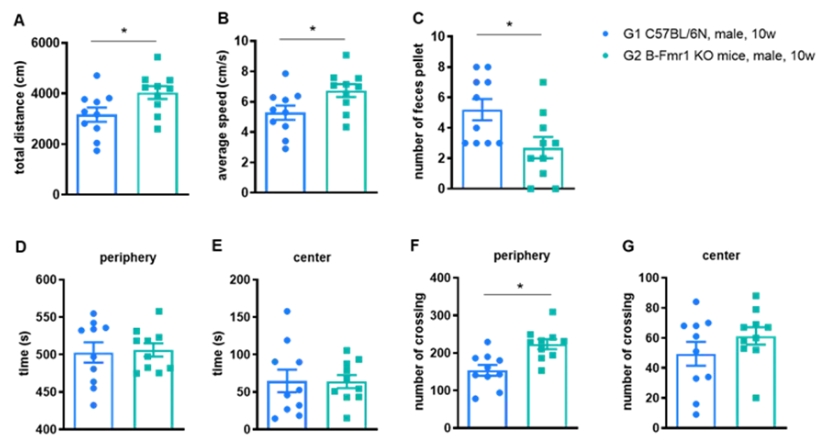
将2-3月龄的C57BL/6小鼠和B-Fmr1 KO小鼠置于开阔的场地,并允许自由探索2小时。对各组大鼠的总运动距离(A)、平均速度(B)、粪粒数(C)、外周和中心停留时间(D、E)、外周和中心穿越次数(F、G)进行评分。数据以均数±标准差表示,采用t检验进行分析。n=10, *P < 0.05。结果显示雄性B-Fmr1 KO小鼠在旷场实验中表现出显著的多动。
ASD相关模型

罕见神经系统疾病动物模型
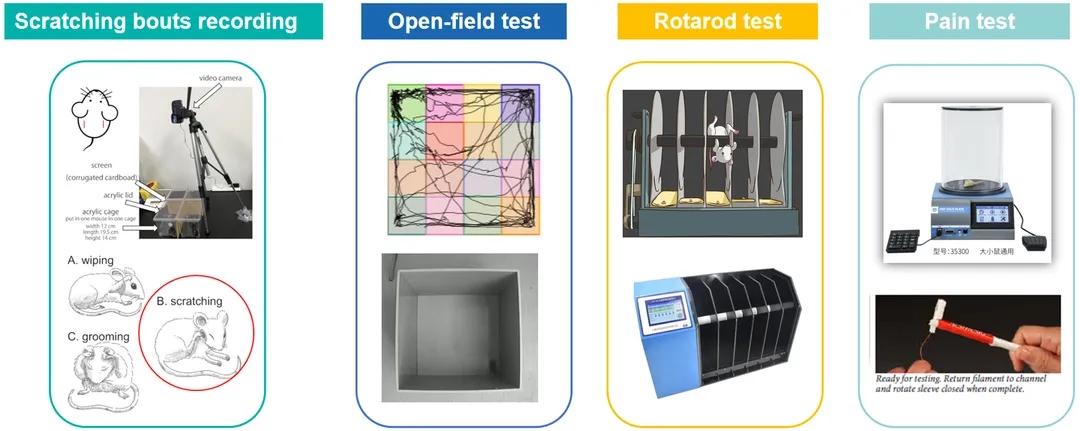
动物行为学实验平台
同时,百奥动物药理药效部动物行为学实验平台,可为客户提供多种动物行为学实验服务,有效支持发病机制研究、创新药物研发、药物安全和风险监测等。
想要了解更多神经系统疾病模型小鼠数据及药效和行为学实验,欢迎扫描下方二维码或拨打电话联系我们。
参考文献:
[1] Kadry H, Noorani B, Cucullo L. A blood-brain barrier overview on structure,function, impairment, and biomarkers of integrity. Fluids Barriers CNS. 2020 Nov18;17(1):69. doi: 10.1186/s12987-020-00230-3. PMID: 33208141; PMCID: PMC7672931.
[2] Nance E, Pun S H, Saigal R, et al. Drug delivery to the central nervous system[J]. Nature Reviews Materials, 2022, 7(4): 314-331.
[3] Breijyeh Z, Karaman R. Comprehensive Review on Alzheimer's Disease: Causes and Treatment. Molecules. 2020 Dec 8;25(24):5789. doi:10.3390/molecules25245789. PMID: 33302541; PMCID: PMC7764106.
[4] Jiang CC, Lin LS, Long S, Ke XY, Fukunaga K, Lu YM, Han F. Signalling pathways in autism spectrum disorder: mechanisms and therapeutic implications.Signal Transduct Target Ther. 2022 Jul 11;7(1):229. doi:10.1038/s41392-022-01081-0. PMID: 35817793; PMCID: PMC9273593.