

干货分享 | 又一城,蛋白提取纯化,收入囊中
- MDL-01
- 北京百奥思科生物医学技术有限公司
- 河北省廊坊市
- 定制协商
- 按需
- 议价
- 2023-09-22 11:54:21
北京百奥思科生物医学技术有限公司
- 关键词
- 分子PCR荧光PCR分子检测实验
随着分子生物学、结构生物学、基因组学等研究的不断深入,人们意识到仅仅依靠基因组的序列分析来试图阐明生命活动的现象和本质是远远不够的。只有从蛋白质组学的角度对所有蛋白质的总和进行研究,才能更科学地掌握生命现象和活动规律,更完善地揭示生命的本质。
由此许多学者将生命科学领域的研究焦点从基因转向蛋白质,使蛋白质成为揭示生命活动现象和分子生物学机理的重要研究对象。研究蛋白质首要的步骤是将目的蛋白从复杂的大分子混合物中分离纯化出来,得到高纯度具有生物学活性的目的物。因此,高效的纯化技术和手段是蛋白质研究的重要基础和关键之一。
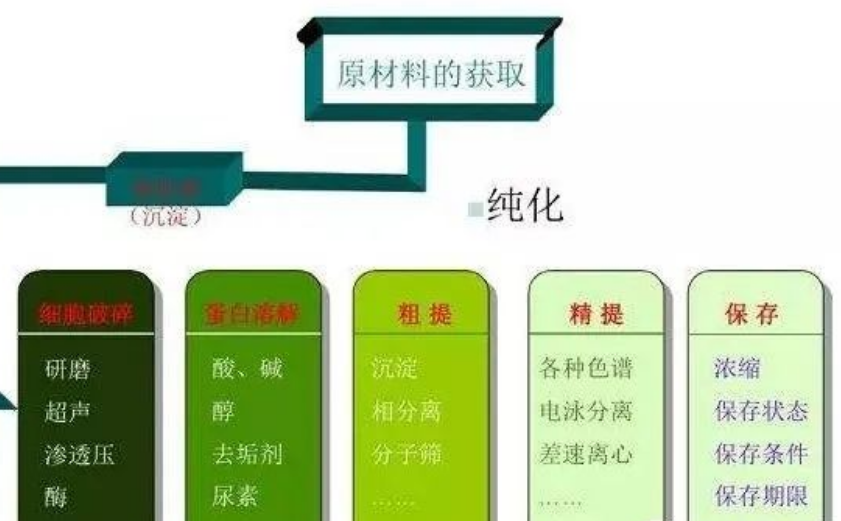
蛋白提取纯化程序
分离纯化某一特定蛋白质的一般程序可以分为前处理、粗分离、精细分离三个步骤。
01、前处理
分离纯化某种蛋白质,首先要把蛋白质从原来的组织或细胞中以溶解的状态释放出来并保持原来的天然状态,不丢失生物活性。
为此,动物材料应先剔除结缔组织和脂肪组织,种子材料应先去壳甚至去种皮以免受单宁等物质的污染,油料种子最好先用低沸点的有机溶剂如乙醚等脱脂。然后根据不同的情况,选择适当的方法,将组织和细胞破碎。
动物组织和细胞可用电动捣碎机或匀浆机破碎或用超声波处理破碎。植物组织和细胞一般需要用石英砂或玻璃粉和适当的提取液一起研磨的方法或用纤维素酶处理也能达到目的。细菌细胞的破碎比较麻烦,破碎细菌细胞壁的常用方法有超声波破碎,与砂研磨、高压挤压或溶菌酶处理等。
组织和细胞破碎后,选择适当的缓冲液把所要的蛋白提取出来。细胞碎片等不溶物用离心或过滤的方法除去。
如果所要的蛋白主要集中在某一细胞组分,如细胞核、染色体、核糖体或可溶性细胞质等,则可利用差速离心的方法将它们分开,收集该细胞组分作为下步纯化的材料。如果碰上所要蛋白是与细胞膜或膜质细胞器结合的,则必须利用超声波或去污剂使膜结构解聚,然后用适当介质提取。
02、粗分离
当蛋白质提取液(有时还杂有核酸、多糖之类)获得后,选用一套适当的方法,将所要的蛋白与其他杂蛋白分离开来。一般这一步的分离用超滤、盐析、等电点沉淀和有机溶剂分级分离等方法。这些方法的特点是简便、处理量大,既能除去大量杂质,又能浓缩蛋白溶液。
03、精细分离
样品经粗分级分离以后,一般体积较小,杂蛋白大部分已被除去。进一步纯化,一般使用层析法包括离子交换层析、亲和层析、疏水层析以及分子筛等。必要时还可选择电泳法,包括区带电泳、等电点聚焦等作为最后的纯化步骤。用于细分级分离的方法一般规模较小,但分辨率很高。
结晶是蛋白质分离纯化的最后步骤。尽管结晶过程并不能保证蛋白一定是均一的,但是只有某种蛋白在溶液中数量上占有优势时才能形成结晶。结晶过程本身也伴随着一定程度的纯化,而重结晶又可除去少量夹杂的蛋白。由于结晶过程中从未发现过变性蛋白,因此蛋白的结晶不仅是纯度的一个标志,也是断定制品处于天然状态的有力指标。
蛋白提取纯化方法
01、蛋白质(包括酶)的提取
大部分蛋白质都可溶于水、稀盐、稀酸或碱溶液,少数与脂类结合的蛋白质则溶于乙醇、丙酮、丁醇等有机溶剂中,因些,可采用不同溶剂提取分离和纯化蛋白质及酶。
(1)水溶液提取法
稀盐和缓冲系统的水溶液对蛋白质稳定性好、溶解度大、是提取蛋白质最常用的溶剂,通常用量是原材料体积的1-5倍,提取时需要均匀的搅拌,以利于蛋白质的溶解。提取的温度要视有效成份性质而定。
一方面,多数蛋白质的溶解度随着温度的升高而增大,因此,温度高利于溶解,缩短提取时间。
但另一方面,温度升高会使蛋白质变性失活,因此,基于这一点考虑提取蛋白质和酶时一般采用低温(5度以下)操作。为了避免蛋白质提取过程中的降解,可加入蛋白水解酶抑制剂(如二异丙基氟磷酸,碘乙酸等)。
下面着重讨论提取液的pH值和盐浓度的选择:
a.pH值
蛋白质,酶是具有等电点的两性电解质,提取液的pH值应选择在偏离等电点两侧的pH 范围内。用稀酸或稀碱提取时,应防止过酸或过碱而引起蛋白质可解离基团发生变化,从而导致蛋白质构象的不可逆变化,一般来说,碱性蛋白质用偏酸性的提取液提取,而酸性蛋白质用偏碱性的提取液。
b.盐浓度
稀浓度可促进蛋白质的溶,称为盐溶作用。同时稀盐溶液因盐离子与蛋白质部分结合,具有保护蛋白质不易变性的优点,因此在提取液中加入少量NaCl等中性盐,一般以0.15摩尔。升浓度为宜。缓冲液常采用0.02-0.05M磷酸盐和碳酸盐等渗盐溶液。
(2)有机溶剂提取法
一些和脂质结合比较牢固或分子中非极性侧链较多的蛋白质和酶,不溶于水、稀盐溶液、稀酸或稀碱中,可用乙醇、丙酮和丁醇等有机溶剂,它们具的一定的亲水性,还有较强的亲脂性、是理想的提脂蛋白的提取液。但必须在低温下操作。
丁醇提取法对提取一些与脂质结合紧密的蛋白质和酶特别优越,一是因为丁醇亲脂性强,特别是溶解磷脂的能力强;二是丁醇兼具亲水性,在溶解度范围内(度为10%,40度为6.6%)不会引起酶的变性失活。另外,丁醇提取法的pH及温度选择范围较广,也适用于动植物及微生物材料。
02、蛋白质的分离纯化
根据蛋白质溶解度不同的分离方法
(1)蛋白质的盐析
中性盐对蛋白质的溶解度有显著影响,一般在低盐浓度下随着盐浓度升高,蛋白质的溶解度增加,此称盐溶;当盐浓度继续升高时,蛋白质的溶解度不同程度下降并先后析出,这种现象称盐析,将大量盐加到蛋白质溶液中,高浓度的盐离子(如硫酸铵的SO4和NH4)有很强的水化力,可夺取蛋白质分子的水化层,使之“失水”,于是蛋白质胶粒凝结并沉淀析出。
盐析时若溶液pH在蛋白质等电点则效果更好。由于各种蛋白质分子颗粒大小、亲水程度不同,故盐析所需的盐浓度也不一样,因此调节混合蛋白质溶液中的中性盐浓度可使各种蛋白质分段沉淀。
影响盐析的因素有:
(a)温度:除对温度敏感的蛋白质在低温(4度)操作外,一般可在室温中进行。一般温度低蛋白质溶介度降低。但有的蛋白质(如血红蛋白、肌红蛋白、清蛋白)在较高的温度(25度)比0度时溶解度低,更容易盐析。
(b)pH值:大多数蛋白质在等电点时在浓盐溶液中的溶解度最低。
(c)蛋白质浓度:蛋白质浓度高时,欲分离的蛋白质常常夹杂着其他蛋白质地一起沉淀出来(共沉现象)。因此在盐析前血清要加等量生理盐水稀释,使蛋白质含量在2.5-3.0%。
蛋白质盐析常用的中性盐,主要有硫酸铵、硫酸镁、硫酸钠、氯化钠、磷酸钠等。其中应用最多的硫酸铵;另外硫酸铵分段盐析效果也比其他盐好,不易引起蛋白质变性。
蛋白质在用盐析沉淀分离后,需要将蛋白质中的盐除去,常用的办法是透析,即把蛋白质溶液装入秀析袋内(常用的是玻璃纸),用缓冲液进行透析,并不断的更换缓冲液,因透析所需时间较长,所以最好在低温中进行。此外也可用葡萄糖凝胶G-25或G-50过柱的办法除盐,所用的时间就比较短。
(2)等电点沉淀法
蛋白质在静电状态时颗粒之间的静电斥力最小,因而溶解度也最小,各种蛋白质的等电点有差别,可利用调节溶液的pH达到某一蛋白质的等电点使之沉淀,但此法很少单独使用,可与盐析法结合用。
(3)低温有机溶剂沉淀法
用与水可混溶的有机溶剂,甲醇,乙醇或丙酮,可使多数蛋白质溶解度降低并析出,此法分辨力比盐析高,但蛋白质较易变性,应在低温下进行。
根据蛋白质分子大小的差别的分离方法
(1)透析与超滤
透析法是利用半透膜将分子大小不同的蛋白质分开。超滤法是利用高压力或离心力,强使水和其他小的溶质分子通过半透膜,而蛋白质留在膜上,可选择不同孔径的泸膜截留不同分子量的蛋白质。
(2)凝胶过滤法
也称分子排阻层析或分子筛层析,这是根据分子大小分离蛋白质混合物最有效的方法之一。柱中最常用的填充材料是葡萄糖凝胶和琼脂糖凝胶。

