肺癌丨精准医疗,针对ALK阳性的靶向治疗
2007年,Hiroyuki Mano博士首次在日本肺癌患者中发现间变性淋巴瘤激酶(ALK)基因与棘皮动物微管相关蛋白样-4(EML4)基因融合
为晚期NSCLC的治疗提供了新的选择和方向。
ALK基因与众多受体酪氨酸激酶(RTKs)共享信号传导途径,在ALK基因重排的情况下,该融合基因编码产生的嵌合蛋白含有EML4的氨基端
和ALK的羧基端,该羧基端包括ALK的整个胞内酪氨酸激酶(TK)结构域,该结构域的异常表达通过自身磷酸化活化下游RAS/MAPK、PI3K/AKT、
JAK/STAT3等通路,从而引起细胞向恶性转化,使细胞增殖不受控制。
LK篇概要
靶向治疗
克唑替尼(一代)
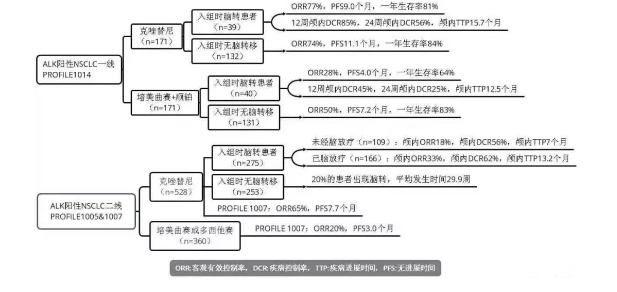
1. PROFILE 1007研究:二线,克唑替尼 vs 化疗,PFS为7.7 vs 3.0个月,ORR为65% vs 20%
2. PROFILE 1014研究:一线,克唑替尼 vs 化疗,ORR为74% vs 45%,校正OS为59.8 vs 19.2个月
3. PROFILE 1029研究(中国人群):一线,研究设计、研究结果与PROFILE 1014相似
阿来替尼(二代)
4. ALEX研究:一线,阿来替尼 vs 克唑替尼,PFS为25.7(研究者评估34.8个月) vs 10.4个月,颅内ORR为81% vs 50%
赛瑞替尼(二代)
5. ASCEND-3研究:二线,合并脑转移组、无脑转移组ORR为57.1% vs 74.7%,OS为36.2 vs 55.3个月
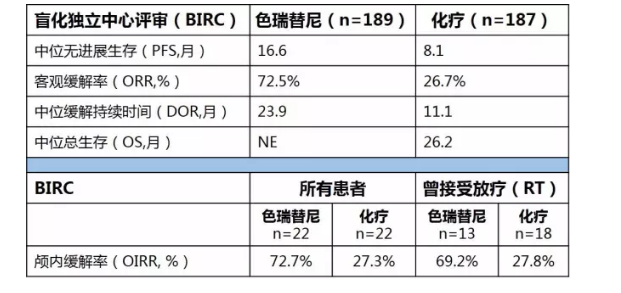
6. ASCEND-4研究:一线,赛瑞替尼 vs 化疗,PFS分别为16.6 vs 8.1个月,颅内ORR为72.7% vs 27.3%
7. ASCEND-8研究:一线,减量(450mg随餐)不减效[ASCEND-4研究(750mg)副作用明显],3年OS率高达93.1%
布加替尼(二代)
8. ALTA-1L研究:一线,布加替尼 vs 克唑替尼,PFS分别为24.0 vs.11.0个月,颅内ORR为78% vs26%
恩莎替尼(国产)(二代)
9. 一项II研究:二线,ORR为52%,PFS为9.6个月,颅内ORR为70%
10. eXalt 3 研究:一线,恩莎替尼 vs 克唑替尼,PFS为25.8 vs. 12.7个月,颅内ORR为54% vs 19%
劳拉替尼(三代)
11. CROWN研究:一线,劳拉替尼 vs 克唑替尼,12个月时PFS率为78% vs 39%[风险比:0.28];颅内ORR为82% vs 23%,CR高达71%
TPX-0131(四代)
12. 临床前研究:ALK复合突变是劳拉替尼的主要耐药机制,TPX-0131对复合耐药突变敏感
耐药机制
13. 第二代能克服克唑替尼的大多数耐药突变,第三代对G1202R较为敏感,复合耐药突变几乎对所有耐药
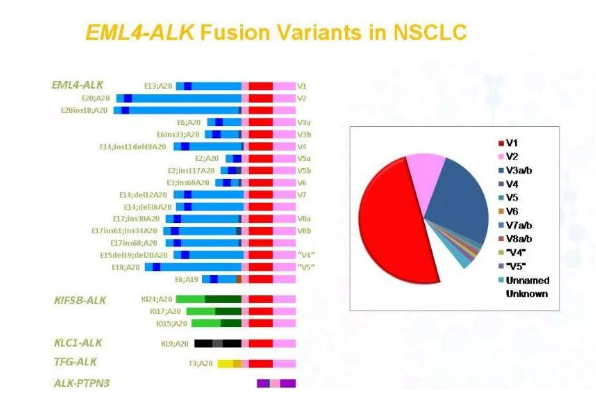
非EML4-ALK个案报道ALK TKI疗效与EML4-ALK相近或更好,也有少部分报道与原发耐药有关。EML4-ALK占90%-95%,
亚型包括:E4; A20(2.34%),E12; A20(1.56%),E13; A20(V1)(40.63%),E6; A20(V3)(36.75%),E20;
A20(V2)(7.81%),E14; A20(V7)(0.78%),E18; A20(V5′)(1.56%),E15; A20(0.78%),E2; A20(V5)(0.78%),E5;
A20(0.78%),E17; A20(1.56%),E3; A20(0.78%),E21; A20(2.34%),少见非A20有:E18;A17,E6; A17,E6;
A18,E6; A19;E13; A19等。日本的一项回顾性研究发现35例接受克唑替尼治疗的ALK阳性肺癌患者中,EML4-ALK变体1(V1)
PROFILE 1007研究[1](二线):一项三期、开放试验,在347例接受过一次铂类药物治疗的局部进展或转移性ALK-阳性肺癌患者中比
较了克唑替尼和化疗的疗效。化疗组患者出现疾病进展时,可以交叉进入克唑替尼治疗组。克唑替尼及化疗组的中位无进展生存期分别
为7.7 vs 3.0个月,缓解率为65% vs 20%。中位总生存期无明显差异。
PROFILE 1014研究[2](一线):一项开放性、三期临床试验,比较克唑替尼与化疗对343例既往未接受过针对晚期肺癌的全身治疗ALK
阳性的晚期非鳞状细胞的NSCLC患者的疗效。这些患者随机分为两组,分别接受克唑替尼治疗(250 mg口服,每天2次),或者接受静
脉化疗(培美曲赛500 mg/m2+顺铂75 mg/m2,或卡铂,曲线下面积目标为5~6 mg/(ml·min),每3周一个疗程,共6个疗程)。
对于化疗组的患者,在出现疾病进展后,允许他们转入到克唑替尼治疗组。本试验的主要终点是无进展生存期。
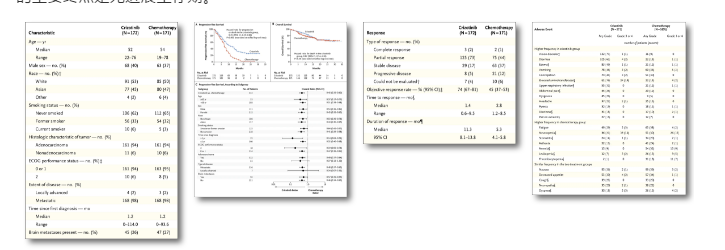
研究结果:克唑替尼组的无进展生存期较化疗组显著延长(中位值,10.9个月对7.0个月)。两组的客观缓解率分别为74%和45%(P<0.001)。
两组的中位总生存期均未达到(克唑替尼组的死亡风险比为0.82)。克唑替尼组的1年生存率为84%,化疗组为79%。克唑替尼组最常见的不
良事件包括视觉障碍、腹泻、恶心以及水肿。化疗组最常见的不良事件为恶心、乏力、呕吐和食欲下降。与化疗相比,克唑替尼可以显著减
轻肺癌的相关症状并大幅提高生活质量。
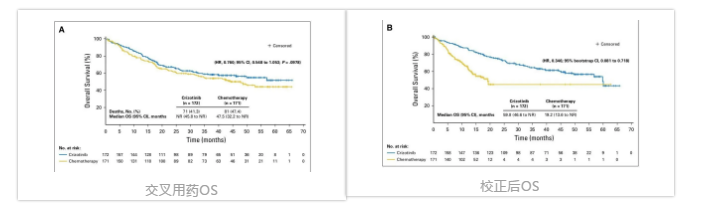
2018年,《J Clin Oncol》公布了最终OS结果[3]。克唑替尼组和化疗组的中位随访时间分别为45.7个月(95%CI,42.7-48.8个月)和45.5个
月(95%CI,43.4-49.1个月)。两组患者的风险比HR为0.760,但无统计学意义(P=0.0978),克唑替尼组的中位OS未达到(NR),化疗组的中位OS为47.5个月。
PROFILE 1029研究[4]:一项随机、开放、双臂III期临床研究,旨在评价在东亚人群(主要是中国人群),克唑替尼一线治疗
既往未经过系统性治疗的ALK阳性NSCLC患者的疗效和安全性。PROFILE 1029试验的研究设计与PROFILE 1014相似,研究结
果再次证实:与标准含铂类化疗药物相比,克唑替尼一线治疗能够显著延长ALK阳性晚期NSCLC东亚患者的无进展生存期(PFS)。
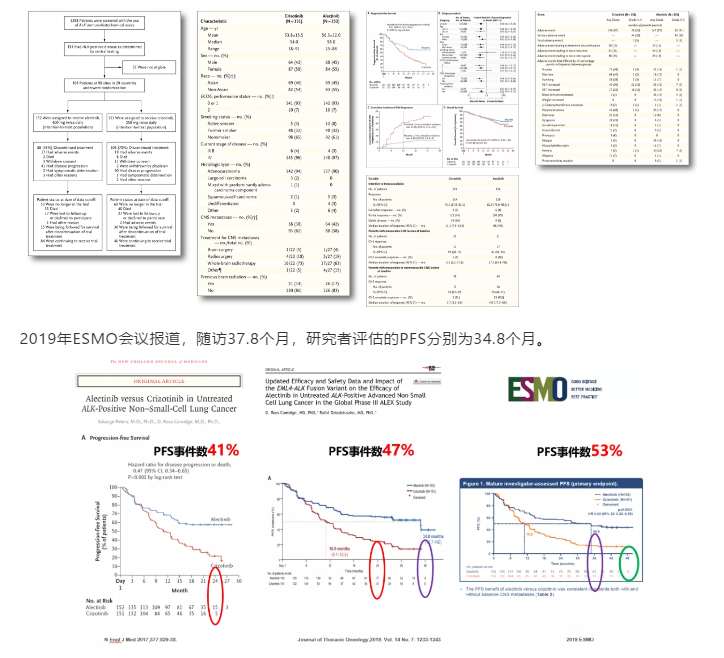
ALEX研究[5](一线):是一项国际性、随机、开放标签的3期试验,在包括无症状CNS转移患者、既往未经治疗的晚期ALK阳性
NSCLC患者中,比较了阿来替尼(600 mg,每日2次)与克唑替尼(250 mg,每日2次)。主要终点是无进展生存期。
研究结果:数据截止2017年2月,克唑替尼组和阿来替尼组的中位随访期分别为17.6个月和18.6个月(164起事件)。在布加替尼组和
克唑替尼组中,12个月无进展生存率分别为68.4% vs 48.7%,ORR分别为82.9% vs 75.5%;独立审核委员会判定的中位无进展生
存期分别为25.7个月和10.4个月(风险比,0.47)。在有可测量病变的患者中,经证实的颅内缓解率分别为81% vs 50%。阿来替尼
组3~5级不良事件的发生率较低(阿来替尼组41% vs. 克唑替尼组50%)。
ASCEND-3研究[6](二线):是一项II期,单臂研究,评估了既往接受≤3种化疗方案且未接受ALK-TKI治疗的患者的疗效及安
全性。根据是否合并脑转移,将124例患者分为两组,分别接受色瑞替尼治疗,合并脑转移组、无脑转移组ORR为57.1% vs 74.7%,
PFS为10.8vs19.6个月,OS为36.2vs55.3个月。最常见的不良反应包括腹泻(85.5%)、恶心(78.2%)、呕吐(71.8%)、食欲降低(55.6%)
及谷丙转氨酶升高(52.4%)。
ASCEND-4研究[7](一线):一项随机、开放标签的III期临床研究,评估一线赛瑞替尼对比化疗治疗晚期ALK阳性NSCLC的疗效。研究入
组的376例患者为未接受过治疗,免疫组化证实为ALK阳性的晚期非鳞NSCLC,中位年龄54岁。按1:1比例将患者随机分配进色瑞替尼治疗组(n=189)
和传统化疗组(n=187)。色瑞替尼治疗组给药:色瑞替尼750 mg/天;其中有59例存在脑转移;化疗组给药:培美曲塞500mg/m2+顺铂
75mg/m2或卡铂AUC 5-6,四周期后培美曲塞维持治疗。按照WHO PS、脑转移和继往新辅助/辅助化疗情况将患者分层。若化疗出现疾病进
展可允许患者交叉进入色瑞替尼组(交叉治疗n=80)。
研究结果:色瑞替尼组的中位药物暴露时间为66.4周,而化疗组仅有26.9周。中位随访持续时间19.7个月(自随机化至截止日),研究实现
了主要目的。在赛瑞替尼组和化疗组中,PFS分别为16.6 vs 8.1个月,ORR分别为72.5% vs 26.7%;中位DOR分别为11.1 vs 23.9个月。
对于基线脑转移可测量以及≥1次基线后评估的患者颅内ORR分别为72.7% vs 27.3%。另外,期中分析只完成了42.3%的需要事件,OS数
据未成熟(HR=0.73, P=0.056)。最常见的不良事件(>50%)在色瑞替尼组为腹泻(85%)、恶心(69%)、呕吐(66%)以及ALT(60%)和AST升高(53%)。
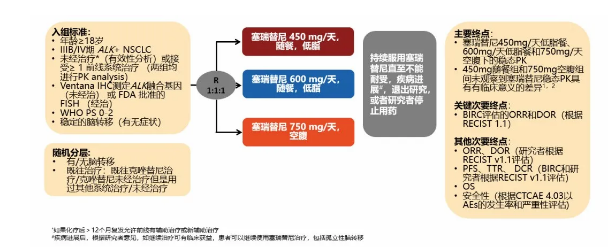
ASCEND-8研究[8](一线,亚洲数据):
在ASCEND-4研究中,塞瑞替尼750mg空腹的疗效显著。但使用750mg空腹剂量,有很多患者因为毒性而暂停药物或者进
行减量。ASCEND-8研究的设计是要看看减少剂量之后,对塞瑞替尼的疗效和安全性产生了什么样的影响。
ASCEND-8是一个随机对照临床试验、对照组采用了750mg空腹模式,然后再加上两个试验组,一组是600mg,一组是450mg
。600mg组和450mg组与750mg最大的不同在于塞瑞替尼是在餐后随餐来使用。所以在这样的剂量下我们主要是看食物对这个药
物的影响,是不是有了随餐服用之后能够延缓药物的吸收,让低剂量随餐来达到更好的效果和减少它的毒性。
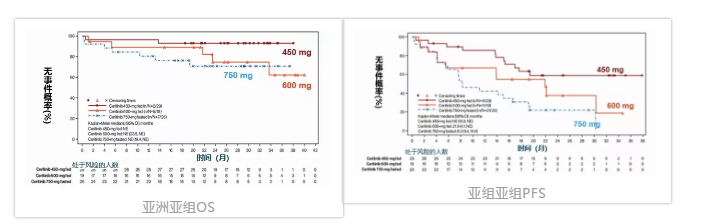
最新结果显示,ASCEND-8研究中的亚洲亚组,塞瑞替尼450 mg/d随餐组3年PFS率高达58.9%。目前最长随访时间已经超过38个月,
经盲法独立评审委员(BIRC)评估,塞瑞替尼450mg随餐组的中位PFS和中位总生存期(OS)仍未达到,3年OS率高达93.1%。塞瑞
替尼450 mg/d随餐组的DCR高达96.6%,ORR高达82.8%。
安全性方面,和750mg空腹组相比,450mg随餐组可显著降低胃肠道AE发生率。450mg随餐组、600mg随餐组和750mg空腹组任意级
别胃肠道AE(恶心、腹泻和呕吐)的发生率分别是82.8%、78.9%和96.2%。三组中各有1例(3.4%)、1例(5.3%)和2例(7.7%)患者
发生3/4级胃肠道AE。
ASCEND-8研究[9](一线,全球数据):2020年WCLC会议公布了意向治疗(ITT)人群中位随访37.65个月后的更新数据。至2020
年3月6日研究结束时,全分析集共包括306名经治和初治的患者,其中疗效分析包括198名初治患者(450mg随餐组,n=73;600mg
随餐组,n=51;750mg空腹组,n=74)。三组经研究者评估的客观缓解率(ORR)和疾病控制率(DCR)均较高,其中450mg随餐
组的ORR达到75.3%,DCR为94.5%;750mg空腹组的ORR为78.4%,DCR为93.2%。450mg随餐组和750mg空腹组的ORR和DCR
相似,但是450mg随餐组的缓解持续时间(DoR)更长,两组分别是未达到和25个月。
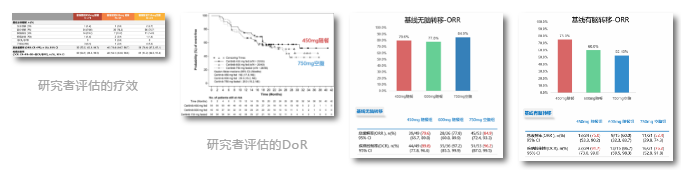
脑转移:在基线无脑转移的患者中,450mg随餐组和750mg空腹组的ORR和DCR相当(ORR:79.6% vs 84.9%;DCR:89.8% vs 96.2%)
而在基线就有脑转移患者在接受塞瑞替尼450mg随餐组和750mg空腹组中基线脑转移患者的ORR分别是75.0%和52.4%,DCR分别是91.7%
和76.2%。对于基线有脑转移患者,450mg随餐方案和750mg空腹方案同样获得较好缓解,而且450mg随餐组在数值上有更好的趋势。
ALTA-1L研究[10](一线):一项开放标签的多中心、随机、3期试验,在既往未接受过ALK抑制剂治疗的ALK阳性NSCLC患者中,比较了布
加替尼和克唑替尼的疗效和安全性。将既往未接受过ALK抑制剂治疗的晚期ALK阳性NSCLC患者随机分组(275例),分别接受布加替尼每日1次、
每次180 mg(包括7日的90mg导入期)治疗,或者克唑替尼每日2次、每次250 mg治疗。主要终点为无进展生存期,次要终点包括客观缓解
率和颅内缓解。
研究结果:第一次期中分析时(99起事件),布加替尼组和克唑替尼组的中位随访时间分别为11.0个月和9.3个月。在布加替尼组和克唑替尼
组中,12个月无进展生存率分别为67% vs 43%,ORR分别为71% vs 60%;在有可测量病变的患者中,经证实的颅内缓解率分别为78% vs
29%。最常见不良事件为胃肠道症状、血肌酸激酶水平升高和血谷丙转氨酶水平升高。
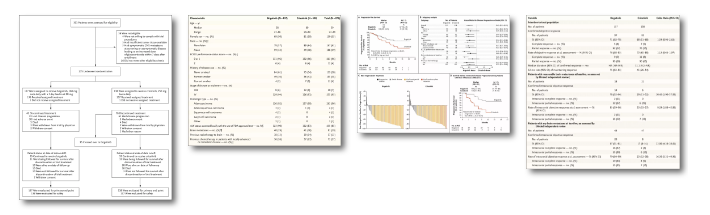
2020年,J Clin Oncol发表了 ALTA-1L研究的第二次中期分析数据[11]。布加替尼组和克唑替尼组的中位随访时间分别为24.9个月
和15.2个月。PFS分别为24.0 vs.11.0个月(HR0.49,BIRC评估)[研究者评估的PFS为29.4vs9.2个月],ORR分别为74% vs 62%
;在有可测量病变的患者中,经证实的颅内缓解率分别为78% vs26%。
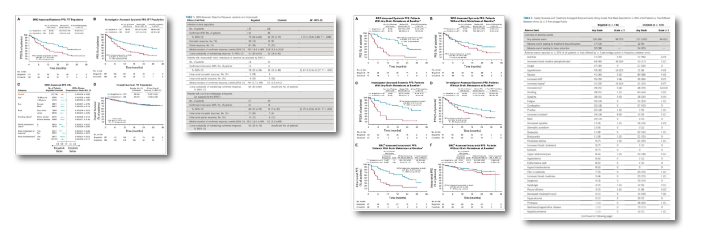
一项II研究[12](二线):2019年12月31日,Lancet Respir Med上发表了盐酸恩莎替尼中国Ⅱ期注册临床研究结果,该研究是由广州中山大学
肿瘤医院张力教授牵头发起。入组了160例克唑替尼治疗耐药后的晚期或转移性ALK阳性NSCLC患者,给予恩莎替尼225mg QD治疗方
案(空腹或与食物同服),主要研究终点为独立评审委员会评估的客观缓解率(ORR)。
研究结果:恩莎替尼治疗克唑替尼耐药后总体人群IRC-ORR为52%(95%CI,43-60),疾病控制率(DCR)为93%(95%CI,88-97)。
研究者评估的中位无进展生存期为9.6个月(95%CI,7.4-11.6)。颅内疗效:40例脑转移基线可测量的患者中,颅内客观缓解率(iORR)
为70%(28/40;95% CI,53-83),颅内疾病控制率(iDCR)为98%(39/40;95 CI,87-100),恩莎替尼对颅内有显著的疗效。
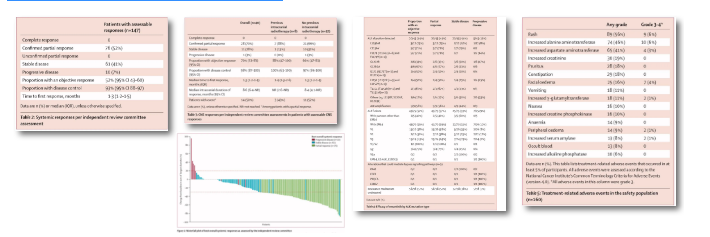
安全性:与治疗相关的最常见的不良事件是皮疹(56%)、ALT升高(46%)、AST升高(41%)、肌酐升高(19%)、便秘(18%)、瘙痒(18%)和面部
水肿(16%)。36例(23%)患者发生了与治疗相关的3级不良事件,未报告与4级治疗相关的不良事件。
eXalt 3 研究[13](一线):是一项全球开放多中心随机对照Ⅲ期一线临床研究,实验组为恩沙替尼225mg QD方案,直至疾病进展;对照组为
克唑替尼250mg BID方案,直至疾病进展,两组之间不允许交叉。2020年WCLC会议上发表的III期eXalt3试验结果显示,与克唑替尼相比,
恩沙替尼的中位PFS明显更长(25.8 vs. 12.7个月;P =0.0003)。在改良的ITT人群中,恩沙替尼的中位PFS尚未达到,而克唑替尼则为12.7个
月。在改良的ITT人群中,恩沙替尼和克唑替尼的ORR分别为75%和67%;在有脑转移的患者中,恩沙替尼的颅内ORR为54%,克唑替尼为19%。
NEJM丨ALK阳性,三代药劳拉替尼大幅度改善PFS
CROWN研究[14](一线):我们开展了一项全球性、随机、3期试验,本试验纳入了既往未因转移性疾病接受过全身性治疗的296例晚期ALK阳
性NSCLC患者,并比较了劳拉替尼和克唑替尼的疗效。
研究结果:1. 在劳拉替尼组和克唑替尼组中,12个月时PFS率为78% vs 39%,疾病进展或死亡的危险比为0.28;ORR为76% vs 58%;
2. 脑转移,在有可测量的脑转移的患者中颅内缓解率分别为82% vs 23%,劳拉替尼组71%的患者达到了颅内完全缓解。3. 劳拉替尼组最常
见的不良事件包括高脂血症、水肿、体重增加、周围神经病和认知受影响。劳拉替尼组的3级或4级不良事件(主要是血脂水平改变)数量
超过克唑替尼组(72% vs. 56%)。两组分别有7%和9%的患者因不良事件停止治疗。
2020年AACR会上,Turning Point Therapeuti公司的崔景荣博士公布了有关第四代ALK抑制剂TPX-0131的临床前数据[15],崔景
荣博士也是第一代ALK靶向药克唑替尼的发明人。
第二代ALK抑制剂能够克服克唑替尼的大多数耐药突变(如L1196M, G1269A、F1174L),但溶剂前沿突变如G1202R将会引起一二代ALK抑
制剂普遍耐药。第三代ALK抑制剂劳拉替尼对G1202R较为敏感,但对复合耐药突变(如G1202R/L1196M)却并不敏感。
TPX-0131是一个紧凑的大环结构,便于与作用位点L1196、G1202等一系列管家基因突变的结合,发挥其作用效果,具有抑制野生型和突变
型ALK耐药突变,包括溶剂前沿突变(G1202R)、守门突变和和复合突变(图1)。
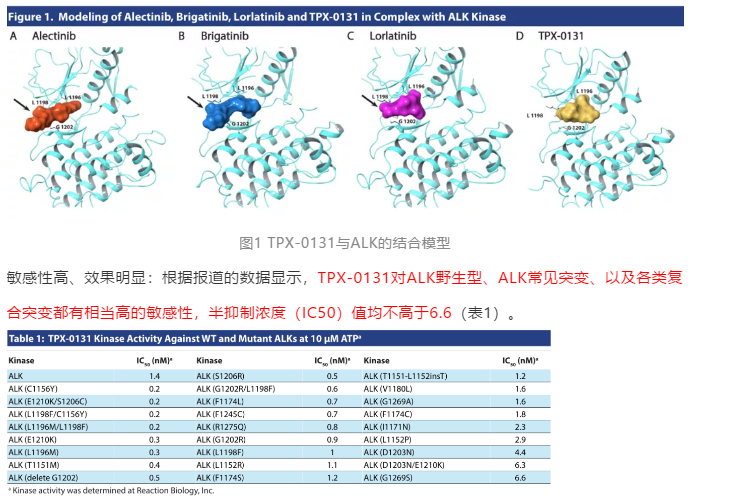
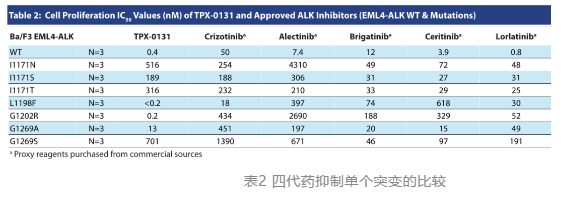
对于L1198F、G1202R、G1269A、以及野生型ALK,TPX-0131都具有比其他TKI更低的IC50值(表2),意味着四代ALK的TPX-0131在
这些靶点的敏感性更高、效果更好,甚至可能会影响到一线、二线及三线药物布局。但是,值得注意的是,TPX-0131对I1171N、I1171S、
I1171T、G1269S的结果并不理想,反而二、三代ALK-TKI对此更为敏感、效果更好(表2)。
TPX-0131是一系列EML4-ALK复合突变最有效的抑制剂,而第1代、第2代和第3代ALK药物均表现为较低的活性和敏感性(表3)。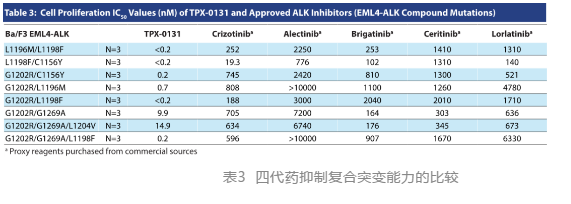
肺癌ALK重排耐药大揭秘,耐药后如何治疗?
第二代ALK抑制剂能够克服克唑替尼的大多数耐药突变(如L1196M, G1269A、F1174L),但溶剂前沿突变如G1202R将会引起一二代ALK
抑制剂普遍耐药。第三代ALK抑制剂劳拉替尼对G1202R较为敏感。

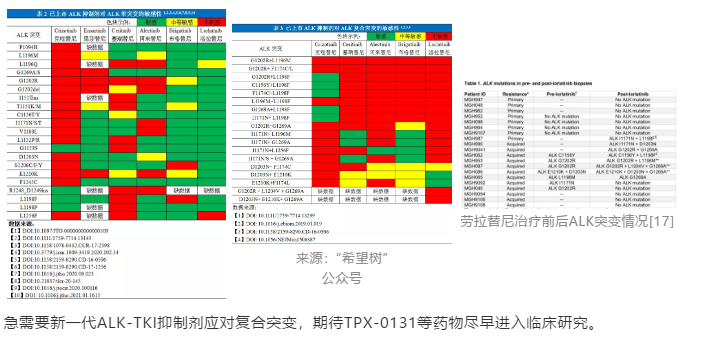
Satoshi Yoda等[17]使用二代测序检测了20名劳拉替尼耐药的ALK阳性肺癌患者组织样本,其中7名患者检出ALK复合突变,
提示ALK复合突变是劳拉替尼的主要耐药机制。
咨询
- 258
- 点赞
- 复制链接
- 举报