全球可授权的CHOK1BN宿主细胞,保证您申报无忧
百英生物拥有一个满足国内外临床申报及生产要求的稳定CHOK1细胞株构建平台。一个优质的稳定细胞株需具备背景可溯源性,生产有高表达性,符合IND的合规性,满足生产的稳定性等各项要求标准。
CHO K1细胞系优势
自1958年Puck实验室建立了CHO细胞原始细胞系,现已出现多种生长、表达、代谢以及基因组等具有差异的细胞系。其中,CHOK1宿主细胞已经广泛用于各种生物抗体药物开发,如治疗性蛋白的开发生产,主要基于CHO-K1细胞其优势:
-
和人类似地翻译后的修饰;
-
能够在无血清及化学限定培养基悬浮培养中以高密度生长;
-
具有产物胞外分泌功能,并且很少分泌自身的内源蛋白,便于下游产物分离纯化;
-
在延长的发酵周期中维持高水平的蛋白质表达。
CHO K1细胞授权问题
尽管不同途径都可获得CHO细胞用于研究,但如果上升到商业化生产,都必须满足“ICH Q5D用于生物技术产品及生物制品生产的细胞基质的来源和鉴定”(ICH Q5D Derivation and Characterisation of Cell Substrates Used for Production of Biotechnological/Biological Products) 的指导原则,所采用的宿主细胞须拥有清晰的历史背景信息,尽可能的确保记录所有传代培养过程中采用的关键原材料信息,用于全面评估其危险,以确保细胞株的安全性。
所以现阶段具有整套合规文件体系的细胞株授权会逐渐成为抗体药、细胞治疗等领域关注的重点。如以新药研发领域为例,细胞株授权贯穿整个药品的生命周期,药品IND、BLA申报都需要细胞株授权。
背景清晰且有成功进入临床或上市产品作为参考的宿主细胞更容易获得监管机构的认可。
目前,细胞株的获取方式有很多,比如自行购买研究级别CHO细胞进行驯化、从供应商直接采购或者委托CRO/CDMO企业进行构建。截至目前为止,从商业化宿主细胞供应商购买特定品系的细胞株直接应用,国内绝大多数的药企采用此方式。
我们的服务
百英生物拥有一个满足国内外临床申报及生产要求的稳定CHOK1细胞株构建平台。一个优质的稳定细胞株需具备背景可溯源性,生产有高表达性,符合IND的合规性,满足生产的稳定性等各项要求标准。我们平台优势:
1、背景可溯源性
百英所拥有的宿主CHOK1BN细胞背景资料及来源清晰齐全。CHOK1BN宿主细胞来源于ECACC的CHOK1宿主细胞并经过CD CHO化学确定培养基悬浮驯化,可进行全球商业化亚授权。

2、CHOK1BN宿主细胞完成DMF备案
百英生物CHOK1BN稳定细胞株满足国内外CDE双报要求,应用于生物制药的研发及生产;同时也完成了FDA的DMF备案,药物申报者可以直接使用该DMF备案编号(037488),为您节省审查和评估时间,提高临床申报的进程。

3、CHOK1BN宿主细胞悬浮驯化
CHOK1宿主细胞由CD CHO最基础培养基进行悬浮驯化,整个悬浮驯化过程都是在无血清化学成分确定的培养基中驯化完成。
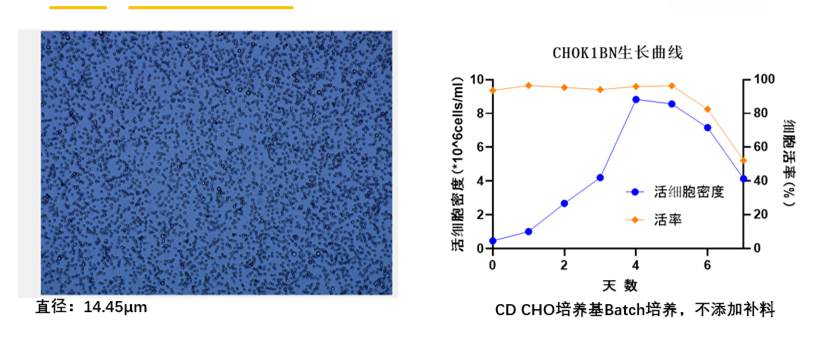
CHOK1BN宿主细胞大小合适
4、CHOK1BN宿主细胞全套检测报告

5、团队经验丰富且具有高表达性
通过驯服驯化筛选,获得具有高表达性的宿主CHOK1BN细胞。
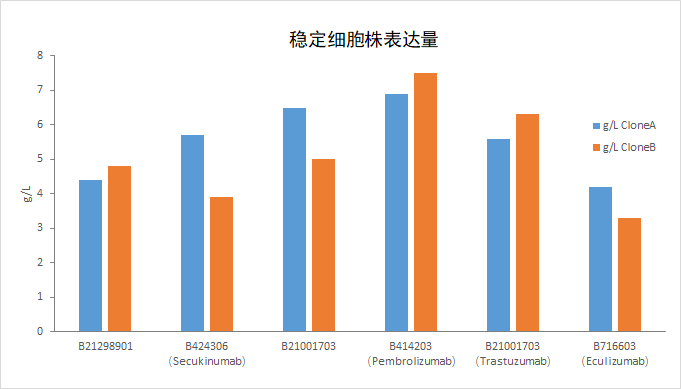
6、连续传代具有可靠的稳定性
满足商业化生产的传代稳定性要求,从多维度考察细胞株的稳定性;
连续传代生长稳定性;
重组蛋白及抗体的表达产量和质量的稳定性;
细胞外源基因的插入位点及拷贝数的基因水平的稳定性。

*细胞株表达量稳定满足CMC放大生产要求,在加压和不加压传代的条件下表达量基本一致。
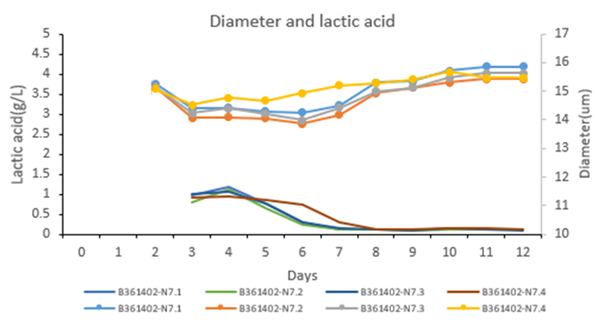
7、乳酸代谢水平低
乳酸代谢维持低水平,有利于CMC大规模生产工艺的参数控制。
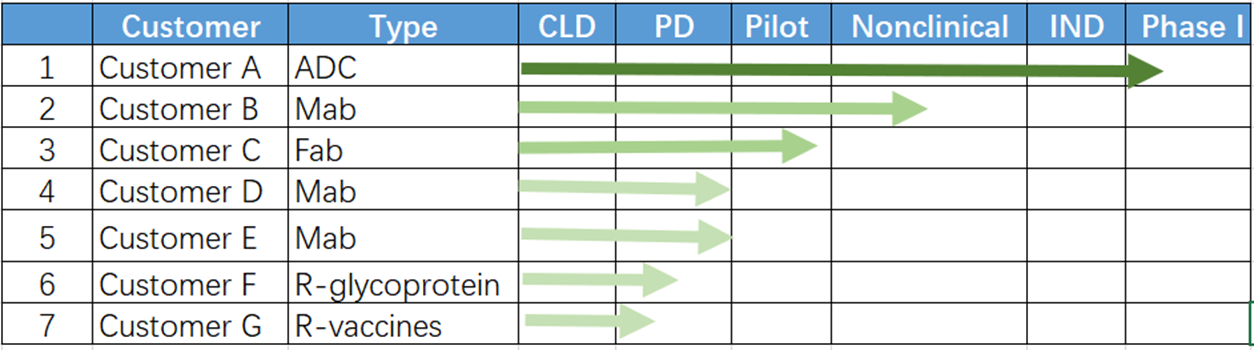
8、授权项目案例
约30+客户使用或授权CHOK1BN细胞,项目类型涵盖激素、疫苗、核药、ADC、单抗、双抗等,最快的项目大约22年9月份拿到IND临床批件。
咨询
- 289
- 点赞
- 复制链接
- 举报




