天然无DNA核酸酶活性的CRISPR-Cas12c系统可有效抑制基因表达
天然无DNA核酸酶活性的CRISPR-Cas12c系统可有效抑制基因表达
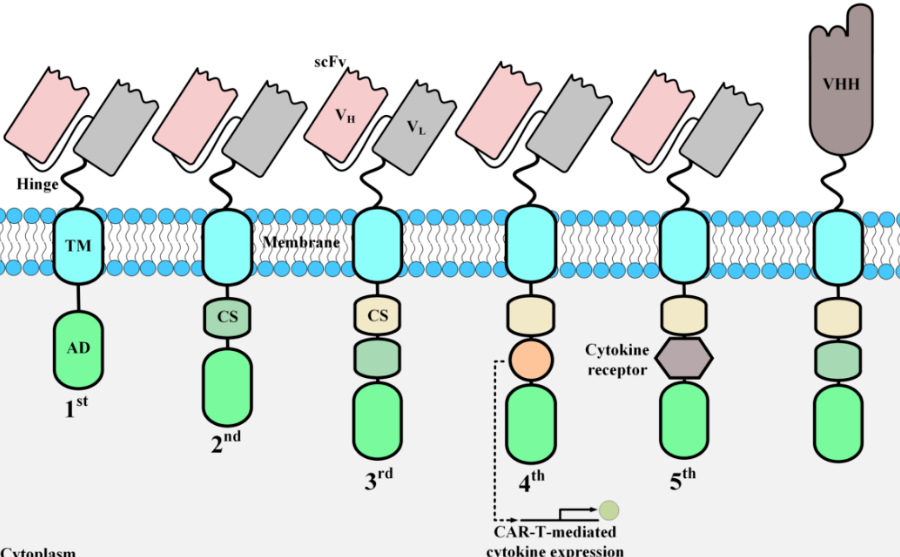
基因编辑领域大放异彩的CRISPR-Cas系统是细菌的获得性免疫系统,细菌借此抵抗噬菌体为代表的病毒感染。迄今研究者已发现两大家族、六种不同类型、超过30种亚类的CRISPR-Cas系统,其中Cas9为代表的II型和Cas12为代表的V型CRISPR-Cas系统被广泛用于基因编辑研究。研究普遍认为CRISPR-Cas系统的核心功能是Cas核酸酶在gRNA的引导下切割双链DNA。不过在众多CRISPR-Cas系统中,Cas12c有其独特性【1, 2】:一方面拥有与传统Cas蛋白类似的RuvC核酸酶功能域,但另一方面Cas12c似乎并无DNA核酸酶活性,只能介导gRNA的剪切和成熟。因此Cas12c的抗噬菌体感染的能力及潜在机制尤为引人注意。
2022年6月2日,来自加州大学伯克利分校(UCB)的Jennifer A. Doudna实验室在Molecular Cell发表题为A naturally DNase-free CRISPR-Cas12c enzyme silences gene expression的论文。文章对Cas12c作为细菌免疫系统抵抗噬菌体感染的作用机制进行了深入研究,发现在gRNA的引导下,Cas12c并非通过切割目标DNA,而是通过结合并抑制靶位点基因的转录最终发挥抗噬菌体感染的功能。这一发现有效拓展了我们对CRISPR-Cas系统抗病毒免疫机制的认识。
文章伊始,研究者通过体外生化实验指出,Cas12c本身并无DNA核酸酶活性,但可以剪切pre-crRNA介导gRNA的成熟,这与已有的研究相吻合。进一步的机制研究发现,Cas12c对pre-crRNA的剪切依赖于RuvC核酸酶功能域。RuvC功能域对pre-crRNA的剪切仍是传统的镁离子依赖性机制,但却丧失了传统Cas核酸酶中RuvC所具有的DNA切割活性。
CRISPR-Cas9系统的gRNA体系包括tracrRNA和crRNA两部分,但Cas9并无剪切pre-crRNA能力;而传统的CRISPR-Cas12系统中,gRNA体系仅包含crRNA且Cas12具有剪切pre-crRNA的能力。对CRISPR-Cas12c系统而言,其gRNA体系包括tracrRNA和crRNA两部分,Cas12c还具有pre-crRNA的剪切能力。研究发现,将tracrRNA与crRNA改造融合获得的sgRNA仍能被Cas12c剪切,这意味着Cas12c系统有望通过单一转录本实现多基因的靶向和调控。
研究指出,pre-crRNA的剪切和成熟对Cas12c与目标DNA的结合非常关键。在成熟gRNA的引导下,Cas12c能识别并结合目标位点的双链DNA。大肠杆菌中的机制研究发现,与DNA目标位点结合后,Cas12c并不能切割双链DNA,但可以抑制目标位点基因的表达,且抑制效果并无方向选择性。此外,研究还证实,Cas12c可通过sgRNA的单一转录本实现多基因的靶向和表达调控。
CRISPR-Cas领域的研究者普遍认为,Cas蛋白的DNA酶切活性是其发挥抗噬菌体感染的关键。本研究中Cas12c双链DNA酶切活性的缺失是否会影响其抗噬菌体感染的能力?研究证实,尽管丧失了双链DNA酶切活性,Cas12c仍能有效的抵抗噬菌体感染。
总体而言,本研究挑战了CRISPR-Cas领域的主流观点,指出Cas蛋白的DNA核酸酶活性对细菌的抗病毒免疫并非不可或缺。研究发现了一种独特的Cas12c蛋白,它本身并无DNA核酸酶活性,但却能剪切处理pre-crRNA,并在成熟crRNA的引导下结合并抑制目标DNA位点的基因表达。这一发现对CRISPR-Cas抗病毒免疫和基因编辑研究都有重要的启示意义。
原文链接
https://doi.org/10.1016/j.molcel.2022.04.020
卡梅德生物拥有成熟的四大核心技术服务平台:
1、稳定细胞系筛选与基础分子生物学平台;
2、抗体工程技术平台;
3、蛋白服务平台;
4、噬菌体展示技术服务平台;
我们成功研发了众多用于科学研究以及新药发现的重组蛋白、抗体、抗体药物靶点蛋白、工业酶、诊断原料等相关试剂,竭诚为您提供服务。
咨询
- 229
- 点赞
- 复制链接
- 举报