一文搞懂 蛋白质互作研究方法
Background
细胞接受外源或是内源的信号,通过其特有的信号途径,调节其基因的表达,以保持其生物学特性。在这个过程中,蛋白质占有很重要的地位,它可以调控、介导细胞的许多生物学活性。虽然有一些蛋白质可以以单体的形式发挥作用,但是大部分的蛋白质都是和伴侣分子一起作用或是与其他蛋白质形成复合物来发挥作用的,忽略蛋白之间的结构和功能联系,很难全面了解蛋白质的功能。因此,为了更好地理解细胞的生物学活性,必须很好地理解蛋白质单体和复合物的功能,这就会涉及到蛋白质相互作用的研究。
蛋白相互作用是指两个或两个以上蛋白质分子,通过非共价键形成蛋白复合物的过程,是构成细胞生化反应网络的主要组成部分。蛋白质间相互作用存在于机体每个细胞的生命活动过程中。理解蛋白质相互作用的方式、作用程度、作用结果,将有助于蛋白功能分析、发育机制探索、疾病发生机制、药物研发等众多问题的解决。
研究蛋白质相互作用时要根据不同的实验目的及条件选择不同的实验方法。蛋白质相互作用的研究方法主要有酵母双杂交、免疫共沉淀、GST-Pull down、生物信息学、噬菌体展示、表面等离子共振、荧光能量转移、荧光共定位等几种,经典的蛋白互作研究方法主要包括酵母双杂交、免疫共沉淀、GST-Pull down和荧光共定位。今天小编就几种经典的方法和优缺点做个简单的概述,希望能够帮助到大家。
酵母双杂交系统(Y2H)
Yeast two-hybrid system
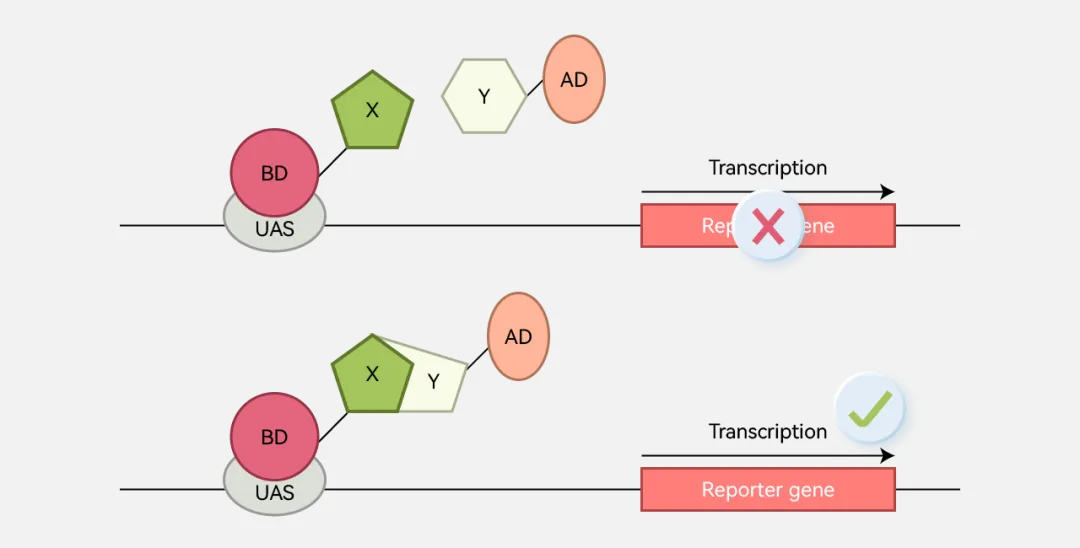
酵母双杂交的原理是把报告基因HIS3和lacZ整合到酵母细胞基因组中,并受转录因子GAL4的调控表达。一旦GAL4蛋白结合到HIS3和lacZ调控序列相应的位点,则启动报告基因的表达。通过检测报告基因的表达判断阳性或阴性。实际应用中,把GAL4基因分成两个部分:DNA结合区(gal4 DNA binding domain, GBD)和激活区(gal4 activating domain, GAD)。分别把GBD和GAD构建到两个不同的载体上,并能表达相应的两个融合蛋白(GBD-X和GAD-Y)。然后把GBD-X和GAD-Y两种载体共转染到带有报告基因的酵母细胞中。当GBD-X融合蛋白中X蛋白与GAD-Y融合蛋白中Y蛋白发生相互作用时(或结合在一起时),就使得原本分开的GBD和GAD蛋白靠近并具有完整的GAL4蛋白的功能,从而能够激活报告基因的表达。
特点:这一经典的蛋白相互作用研究方法接近于体内环境,那些瞬时、不稳定的两两相互作用也可以被检测到,并且与内源蛋白的表达无关。鉴于这些优点并结合简便高效的Gateway表达载体构建方法,在大规模的蛋白质-蛋白质相互作用研究中酵母双杂交系统得到了最为广泛的应用,成为用来筛选未知的相互作用蛋白的重要方法。
局限:(1)不能研究具有自激活特性的蛋白质;(2)只能检测两个蛋白间的相互作用;(3)检测的相互作用需要发生在细胞核内,而许多蛋白间的相互作用依赖于翻译后加工如糖基化、二硫键形成等,这些反应在核内无法进行,对于不能定位到细胞核中的蛋白质无法研究。另外有些蛋白的正确折叠和功能有赖于其他非酵母蛋白的辅助,这限制了某些细胞外蛋白和细胞膜受体蛋白等的研究;(4) 酵母双杂交系统的一个重要的问题是“假阳性”。由于某些蛋白本身具有激活转录功能或在酵母中表达时发挥转录激活作用,使DNA结合结构域杂交蛋白在无特异激活结构域的情况下可激活转录。另外某些蛋白表面含有对多种蛋白质的低亲和力区域,能与其他蛋白形成稳定的复合物,从而引起报告基因的表达,产生"假阳性"结果。大部分实验中有将近50%的假阳性率,且推测的相互作用仅有3% 在两种以上的实验中得到验证。
GST-Pull down
GST-Pull down assay
上面提到,用酵母双杂交方法筛选到的蛋白需要作进一步的鉴定。鉴定方法之一就是GST-pull down实验。GST-pull down实验主要是用来证明蛋白质胞外的相互作用。蛋白质在胞外的相互作用排除了酵母细胞内复杂体系的干扰,比较直接地检验蛋白质分子之间存在的物理的相互作用。
原理是将诱饵蛋白质和用谷胱甘肽-s-转移酶(glutathione-S-transferase,GST)标签在细菌、动物细胞等体系中融合表达,一步纯化后与含有目的蛋白质的溶液进行孵育。利用谷胱甘肽亲和树脂将GST-融合蛋白-目的蛋白复合物沉淀下来,然后进行聚丙烯酞胺凝胶电泳(SDS—PAGE) 鉴定与GST融合蛋白相互作用的蛋白(CYTOCH提供高质量的GST-pull down试剂盒,货号:PM1031);
优点:外源表达系统简单易用、蛋白表达周期短,且GST融合蛋白和谷胱甘肽有很高的亲和性,易分离出大量融合蛋白进行批量实验。
局限:GST Pull-down的融合诱饵蛋白往往是在外源系统中表达,可能会缺少某些翻译后修饰,并且和靶蛋白的结合发生在体外环境,不能精确反映内体的相互作用。

免疫共沉淀法(Co-IP)
Immunocoprecipitation
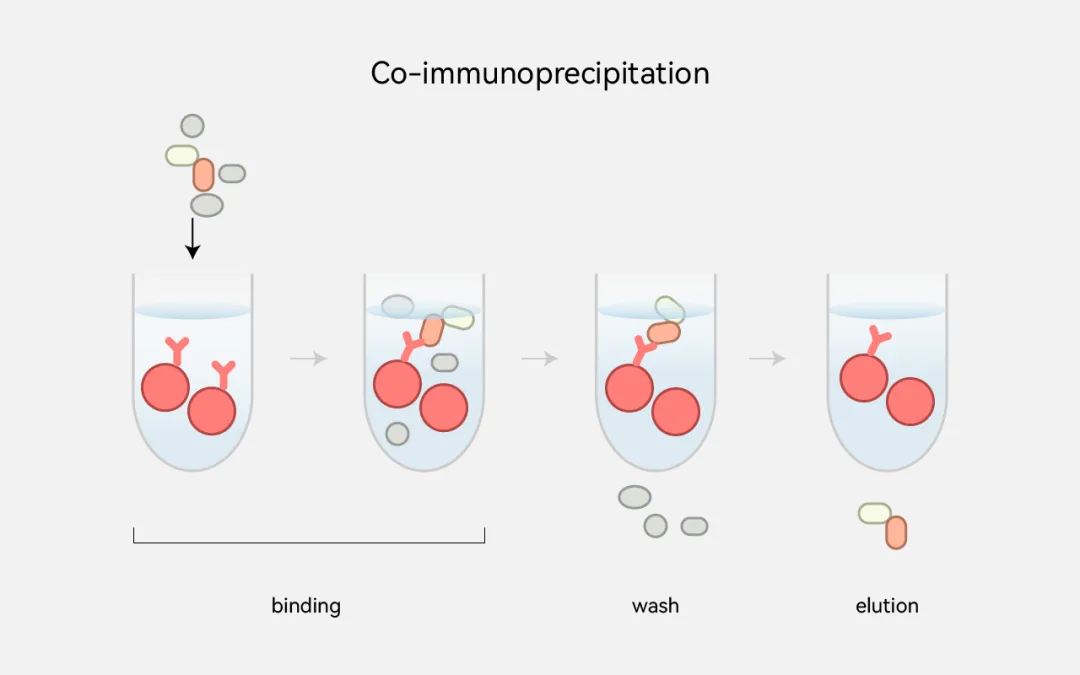
免疫共沉淀技术用来证明蛋白质在胞内是否有相互作用。一般来说,两种蛋白在细胞内发生相互作用时会形成两种蛋白的复合物,这样就可以先用一种蛋白的抗体把免疫复合物沉淀下来,然后用另一种蛋白的抗体进行Western blotting检测。又可以分为(1)细胞内过表达蛋白的免疫共沉淀。证明蛋白质胞内相互作用时,把两种蛋白基因共转染到细胞内进行表达。由于人为进行大量表达,所以在胞内两种蛋白形成相互作用的复合物的量也相应增多。如果你手头没有这两种蛋白的抗体,可以把这两种蛋白的一端分别加上不同的标签以融合蛋白形式表达,然后用商业化的抗标签抗体进行免疫共沉淀和Western blotting检测。(2)细胞内源性蛋白的免疫共沉淀。把两种蛋白共转染到细胞内进行过表达,进行免疫共沉淀实验,相对容易成功,但是这一结果毕竟具有人工性,不能代表生理条件下真实的蛋白质相互作用。要想克服这一弱点,可以做内源性的免疫共沉淀实验。这一技术要求极高,难度极大,但也最有说服力。因为细胞内内源性蛋白含量低,结合在一起形成复合物的量更低,难以检测。首先要证明所选择的细胞系是否具有这两种内源性的蛋白。另外,用于免疫沉淀和Western blotting检测的抗体要好。细胞裂解、收集以及免疫沉淀时时条件要温和,以保持蛋白复合物的天然结构。(3)组织内蛋白的免疫共沉淀。取动物组织(脑、肝、脾等),切碎,匀浆,提取组织蛋白,进行免疫共沉淀实验。这一结果代表活体中蛋白质相互作用(CYTOCH提供种类丰富的免疫沉淀磁珠和高质量的免疫沉淀试剂盒,参考产品表格清单)。
优点:研究的是存在于正常生理条件下蛋白质间的相互作用 ,是确定蛋白质在完整细胞内生理性相互作用的有效方法。可以研究复合体中直接/间接互作的多个蛋白。
局限:可能检测不到低亲和力和瞬间的蛋白质相互作用。不能证明两种蛋白质的直接结合,其他分子可能起到桥梁作用。依赖于高质量的可用于免疫沉淀的特异性抗体。
荧光共定位
Fluorescence colocalization
另一种经常用来检验蛋白质相互作用的方法是蛋白质细胞内定位技术。此法较为直观,可以看到两种有相互作用的蛋白质在细胞内的分布(膜上、胞浆、胞核或其它细胞器等等)以及共定位的部位(在膜上共定位、在胞浆中某一部位或核内共定位等等)。有时相互作用的蛋白由于细胞内某种功能的需要结合在一起时,使得两种蛋白的分布发生变化。比如,某种蛋白也许在核内,当它与另一种具有穿梭功能的蛋白结合时,有可能被转运到胞浆中,这种情况的共定位则较为典型。如果两种荧光出现在同一位置,那么就证明它们空间上较为接近,很有可能产生了相互作用。
1/ 利用有色荧光蛋白标记技术进行蛋白定位研究。此法也可称为活细胞定位。把两种具有相互作用的蛋白分别克隆到带有两种不同颜色荧光蛋白(绿色荧光蛋白或红色荧光蛋白)的载体中,共转染到功能细胞中表达带有荧光的融合蛋白。这样,相互作用的两种蛋白就被标上不同的荧光,可以在细胞内用荧光显微镜直接观测。在进行精确细胞定位或共定位时,必须用共聚焦荧光显微镜观测。因为共聚焦荧光显微镜(相当于医院给病人诊断的CT)观测的是细胞内一个切面上的颜色。如果在一个切面上在同一区域看到两种颜色,就提示这两种蛋白在该区域内有相互作用。普通荧光显微镜看到的是一个立体图象,无法确定蛋白质共定位现象。在进行定位或共定位同时,也可以对细胞核进行染色。这样,在细胞中就有三种颜色。细胞核的显色帮助你确定共定位发生的位置。
优点:是表达的荧光蛋白荧光强,没有背景,观测方便。
缺点:相互作用的蛋白由于标上荧光蛋白,实际上是两个融合蛋白。融合蛋白的定位结果或共定位结果是否与天然蛋白分布一致,有待于进一步确定。而利用免疫荧光标记技术可以避免这一缺点。
2/ 利用双色或多色染色的免疫荧光技术进行蛋白定位研究。首先把细胞进行固定,然后用待检测靶蛋白的抗体(一抗)与细胞内靶蛋白进行免疫反应,再用荧光素(如FITC和TRITC等)标记的二抗与一抗进行反应。这样就在细胞内形成免疫复合物,结果靶蛋白被标上颜色,然后可用共聚焦荧光显微镜观测定位与共定位结果。
优点:是可用来检测细胞内源性蛋白的定位及相互作用。当然也可以对靶细胞进行转染表达目的蛋白,然后标记目的蛋白进行观测。
缺点:是荧光相对较弱并且背景较高,结果受到干扰,所以这项技术不好掌握。为了结果的可靠性,要求严格设计阳性对照与阴性对照。
Summary
每种方法都有其优势和局限,因此在选择时需要根据具体的研究目标和实验条件进行综合的考虑。当实验条件满足时,可以使用多种实验来证明蛋白的相互作用,以相互弥补单一方法的局限。
咨询
- 154
- 点赞
- 复制链接
- 举报

